金属的化学性质2
Ⅰ、知识梳理
1.金属活动性顺序
![]() 金属还原性 强
弱
金属还原性 强
弱
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
2.一价原子量法公式 mH2==(用于不同金属产生相同氢气时,比较所需金属的质量;或用于相同质量的不同金属,比较产生氢气的质量)(给出推导过程)
Ⅱ、范例研究
一、金属Mg 、Fe 、Zn 分别与足量的稀硫酸(或稀盐酸)反应。
化学方程式 M+2HCl![]() MCl2+H2↑(M=Mg、*Fe、Zn)
MCl2+H2↑(M=Mg、*Fe、Zn)
H2SO4 MSO4
1. 反应速度由大到小的顺序是_______________。
2. 若要制取等质量的H2 ,则消耗Mg 、Fe 、Zn由少到多的顺序是__________、消耗金属的质量比是_________________。
3. 若等质量的金属参加反应
⑴ 产生H2由多到少的顺序是_______________、产生H2 的质量比______________。
![]() ⑵ 以横坐标表示金属的质量,纵坐标表示H2 的质量,画出化学反应的图象。
⑵ 以横坐标表示金属的质量,纵坐标表示H2 的质量,画出化学反应的图象。
 |
第⒊⑵小题 第⒊⑶小题
⑶ 以横坐标表示反应时间,纵坐标表示H2 的质量,画出化学反应的图象。
二、金属Al 、Mg 、Fe 、Zn 分别与足量的稀硫酸(或稀盐酸)反应。
化学方程式 、
⒈ 反应速度由大到小的顺序是_______________
⒉ 若要制取等质量的H2 ,则消耗Al、Mg 、Fe 、Zn由少到多的顺序是__________、消耗金属的质量比是_________________
⒊ 若等质量的金属参加反应
⑴产生H2由多到少的顺序是_______________、产生H2 的质量比______________
![]() ⑵ 以横坐标表示金属质量,纵坐标表示 H2质量,画出图象(添在第⒊⑵小题图中)
⑵ 以横坐标表示金属质量,纵坐标表示 H2质量,画出图象(添在第⒊⑵小题图中)
⑶ 以横坐标表示反应时间,纵坐标表示H2质量,画出图象(添在第⒊⑶小题图中)
 三、把等质量的锌片,分别插入FeCl2 、MgSO4和AgNO3溶液中。
三、把等质量的锌片,分别插入FeCl2 、MgSO4和AgNO3溶液中。
以横坐标表示反应时间,纵坐标表示固体质量,根据固体质量
随时间的变化情况,画出图象(右边方框中)
四、除杂题
1.Cu(Fe)试剂______________________
化学方程式 ___________________ 、____________________
2.Cu(CuO)试剂 (错解 ) 第三题
化学方程式 ___________________ 、____________________
练 习 题
相对原子质量:H一1 C一12 N—14 O一16 S一32 Cl一35.5 K一39 Ca一40 Cu一64
一、选择题(每小题只有一个正确答案)
1.下列溶液能由金属与酸直接反应制取的是·························································· 【 】
A.FeCl3; B.uSO4; C.gCl2 D.Fe2(SO4)3。
2.X、Y、Z三种金属,根据方程式:Z+YSO4![]() Y+ZSO4;X+YSO4
Y+ZSO4;X+YSO4![]() XSO4+Y;
XSO4+Y;
Z+H2SO4![]() ZSO4+H2
ZSO4+H2![]() ;X+H2SO4
;X+H2SO4![]() 不反应,可知三种金属的活动性顺序·············· 【 】
不反应,可知三种金属的活动性顺序·············· 【 】
A.Z.>X>Y B.Z>Y>X C.X>Y>Z D.Y>X>Z
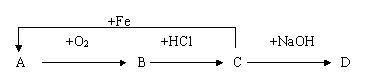
3.下列物质存在以下的反应关系,则A的分子式可能是·········································· 【 】
![]()
A.C B.Zn C.Cu D.Mg
4含有杂质的Fe的混合物共28克,与足量的稀硫酸反应,放出氢气1.1克,则其中的杂质是 【 】
A、Cu B、Zn C、Mg D、Ag
5.将混有少量氧化铜的锌粉,放入盛有稀硫酸的烧杯中,充分反应后,有锌粉剩余,过滤,滤液含有的溶质是 【 】
A.ZnSO4 B.H2SO4 C.ZnSO4和CuSO4 D.H2SO4和ZnSO4
6.将Ag、Mg、Fe、CuO组成的混合物放入足量的稀硫酸中,反应完成后,溶液呈蓝绿色,然后过滤,滤纸上留下固体,可能是······················································································································ 【 】
A、Ag、Mg B、Fe、Ag C、Cu、Ag D、MgFe
7.通常状况下,一种无色气体a和灼热的木炭反应,可得另一种无色气体b,b与无色气体c化合,又可得到a,则a、b、c依次为················································································································ 【 】
A.CO、CO2、O2 B.H2O、H2、O2 C.CO2、CO、O2 D.O2、CO2、CO
8.有三种金属M、N、R。其氧化物中只有N的氧化物溶于水,且水溶液pH值大于7,又知R能从AgNO3溶液中置换出Ag,R不溶于盐酸,M能在O2中剧烈燃烧,火星四射,生成黑色固体物质,则M、N、R在金属活动顺序表中的正确位置是 【 】
A、M、N、(H)、R B、R、M、(H)、N
C、R、(H)、M、N D、N、M、(H)、R
二、填空题
1. 在ZnCl2、FeCl3、CuCl2中不能由金属与盐酸直接反应制得的是____________________
2. 新买的铝壶烧开水时,凡水浸到之处都会变黑,这是水中含有可溶性的________________
3. m克两价金属与足量的稀硫酸完全反应,产生n克H2 ,该金属的相对原子质量为 ______。
4.向铁粉和氧化铜的混合物中,加入一定量的稀硫酸,反应停止后,过滤、除去不溶物。再向滤液中插入一根铁丝,又放出气泡,则滤出的不溶物中含有 ;滤液中一定含有
和水,可能含有 。
5.在盐酸、硝酸铜溶液、铁片、硝酸银溶液四种物质中,写出两两反应的化学方程式及化学反应的基本类型。
6.把锌片分别插入一定浓度足量的FeSO4 、CuCl2 、AgNO3 三种 W固体
![]()
![]() 溶液中,假设单位时间内消耗的质量相等,而剩余的锌片质量
A
溶液中,假设单位时间内消耗的质量相等,而剩余的锌片质量
A
![]()
![]() 加附着金属的质量如右图所示:
B
加附着金属的质量如右图所示:
B
则A表示插入 溶液,B表示插入 溶液, C
![]() C表示插入 溶液。
反应时间
C表示插入 溶液。
反应时间
7.实验室有铁、氧化铜、氧化铁、硫酸等物质,请你从上述物质中选取原料制取铜,设计二个不同的实验方案,用化学方程式表示:
(1)方案A:____________________ 、____________________
(2)方案B:____________________、____________________
8.X、Y、Z分别是Fe、Cu、Hg、Ag四种金属元素中的一种,X的单质能够从Y的盐溶液中置换出Y,但不能从Z的盐溶液中置换出Z,也不和稀盐酸反应,Z的单质也能够从Y的盐溶液中置换出Y,但不能置换出盐酸中的氢。
(1)三种金属的活动性由强到弱的顺序是 (用X、Y、Z表示)
(2)若X是Hg,则Y是
(3)写出Z和Y的硝酸盐溶液发生反应的化学方程式
(Y、Z用相应的元素符号表示)。
三、实验题
1.A,B两种物质都是黑色粉末,A,B的混合物在一定条件下发生如下反应:
![]()
|
|
![]()
![]()
|
|
|
![]()
![]()
根据上述变化关系和现象,回答下列问题:
(1)写出两种黑色粉末的化学式:A是 B是
(2)写出变化①,②的化学反应方程式
① ②
2.现有铁片、铜片、盐酸及硝酸银溶液4种试剂,为了确定Fe 、Cu 、Ag 和H的活动性顺序,则最少要进行以下几个实验,将设计的实验,现象和结论填入下表:
| 实 验 操 作 | 现 象 | 结论(用化学方程式表示) |
| 实验1: | ||
| 实验2: | ||
| 实验3: |
活动性顺序为_____________________。
3.实验桌上有锌、铜、稀硫酸、硫酸锌溶液、硫酸亚铁溶液和硫酸铜溶液六种物质
请选用上述物质,设计两种方案证明锌比铜活泼。
| 所选物质 | 结论(用化学方程式表示) | |
| 方案一 | ||
| 方案二 |
四、计算题
1.将150克的铁棒浸入到硫酸铜溶液中,反应片刻后取出,洗净干燥后称量,铁棒变为155.6克。计算:⑴析出铜多少克?⑵消耗铁多少克?(3)生成硫酸亚铁多少克?
2.有3.2克铁和铜的混合物,与100克稀硫酸恰好完全反应生成气体0.1克。求:
①混合物中Fe % ②H2SO4% ③反应后 ZnSO4%
3.有一块氧化的镁片4.0克与100克稀盐酸恰好完全反应,得到标准状态下的氢气2.24升氢气的密度为0.09克/升。求:⑴镁片中单质镁的百分含量⑵原盐酸溶液的质量百分比浓度⑶生成物溶液的质量百分比浓度
4.某学生利用多种仪器设计一套发生H2的实验装置,并用排水集气法将H2吸收于量筒中,用秒表记录反应时间,观察一定时间内产生H2的体积(标准状况)。实验记录如下:
| 时间/分 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| V(H2)/毫升 | 100 | 160 | 200 | 224 | 224 | 224 | 224 | 224 |
已知65克锌与足量盐酸反应,能产生22.4升H2(标准状况)。上述实验中加入的10克盐酸反应后只用去一半,则反应产生的氢气为 升,反应的锌为 克,原盐酸中溶质的质量百分比浓度为 。
计算过程:
五、开放性试题
在一密闭容器中盛有a克木炭粉和b克氧气,将其在高温下充分反应,回答:
⑴当反应后留下的物质只有CO2 时,则a∶b=
⑵当反应后留下的物质只有CO时,则a∶b=
⑶当反应后生成物既有CO2又有CO时,则![]() 的关系可用下式表示
的关系可用下式表示