初三化学期末试卷
可能用到的相对原子质量: H-1 C-12 O-16 S-32 Ca-40
一、填表题(24分)
1. 根据所给名称的要求,写出相应的化学符号:
| 名称 | 1个银原子 | +3价的铁元素 | n个二氧化碳分子 | 2个氮气分子 |
| 化学符号 |
2. 在下表的空格内写出相应的物质名称或化学式(分子式),并指出物质的类别(单质、氧化物、酸、碱、盐):
| 物质名称 | 氯气 | 氧化铁 | 硝酸 | ||
| 化学式 | Al(OH)3 | FeSO4 | |||
| 物质类别 |
3. 根据所给的化学反应,填写化学方程式,并简答有关问题:
| 化学反应 | 化学方程式 | 简答 |
| 二氧化碳通入灼热的碳 | 反应类型______________ | |
| 硫在空气中燃烧 | 反应现象______________ | |
| 水在通电条件下的反应 | 各生成物的质量比为_______ | |
| 氯酸钾与二氧化锰共热 | 在本反应中,二氧化锰起_____作用 | |
| 在硫酸铜溶液中滴入氢氧化钠溶液 | 生成物的沉淀是_______色 |
二、选择题(19分)
4.日常生活中发生的下列变化都属于化学变化的一组是······································· 【 】
A.玻璃杯被摔碎、米饭变馊 B.酒精挥发、湿衣服晾干
C.蜡烛燃烧、乒乓球变瘪 D.菜刀生锈、牛奶变酸
5.生活中的下列物质,属于纯净物的是································································ 【 】
A.豆浆 B.酱油 C.糖水 D.蒸馏水
6.将面粉、味精、食盐、酒精分别放入水中,不能形成溶液的是························· 【 】
A.面粉 B.味精 C.食盐 D.酒精
7.决定元素种类的是原子的················································································· 【 】
A.质子数 B.中子数 C.电子数 D.最外层电子数
8.下列符号中,既表示一个原子,又表示一种元素,还表示一种物质的是··········· 【 】
A.C60 B.2H C.2H2 D.Hg
9.吸烟有害健康,在公共场所吸烟,会使周围的人被动吸“二手烟”。“二手烟”中含
有一种能与人体血液中血红蛋白结合的有毒气体,该气体是·································· 【 】
A.N2 B.O2 C.CO2 D.CO
10.将80克KNO3饱和溶液,从60℃降低到20℃。在这个过程中不变的是············· 【 】
A.溶质质量 B.溶剂质量 C.溶解度 D.溶液的质量百分比浓度
11.下列叙述中,正确的是··················································································· 【 】
A.二氧化碳分子是由一个碳原子和一个氧分子构成的
B.不同元素的原子其核电荷数一定不同
C.原子是构成物质的最小微粒
D.核外电子数相同的微粒一定属于同种元素
12.除去CO2中混有的少量CO杂质可采用的适宜方法是······································ 【 】
A.点燃混合气体 B.将混合气体通过石灰水
C.将混合气体通过灼热的CuO D.将混合气体通入水中
13.某学生使用托盘天平称量固体药品时,将药品放在右盘上,然后在左盘上加了8克砝码,并移动游码到0.8克处,天平达到了平衡,则此药品的重量是············································································ 【 】
A.8.8克 B.7.20克 C.7.2克 D.7.8克
14.下列物质中,含碳的质量分数最大的是····························································· 【 】
A.CO B.CH4 C.C2H2 D.CO2
15.大气中的臭氧层能吸收来自太阳辐射的紫外线,保护地球上的生物。有关臭氧(O3)
的下列说法中,错误的是······················································································· 【 】
A.臭氧和氧气是同一种物质 B.每个臭氧分子中有3个氧原子
C.臭氧由氧元素组成 D.臭氧中氧元素是游离态
16.在氢气还原氧化铜的实验中,进行如下操作:①加热②停止加热③通入氢气④停止通入氢气。下列操作顺序正确的是 【 】
A.③①④② B.①③②④ C.③①②④ D.①③④②
17.有100克溶质质量分数为5%的食盐溶液,若将其溶质的质量分数提高到20%,则采取的措施是 【 】
A.蒸发55克水 B.蒸发75克水 C.加入5克固体食盐 D.加入15克固体食盐
18.在氧化-还原反应CO+CuO![]() CO2+Cu中,氧化剂是·························· 【 】
CO2+Cu中,氧化剂是·························· 【 】
A.CuO B.C C.CO D.Cu
19.将氮气、一氧化碳、二氧化碳的混合气体先通过足量澄清的石灰水、再通过足量灼热的氧化铜,最后剩余气体是····························································································································· 【 】
A.氮气 B.二氧化碳 C.一氧化碳 D.二氧化碳和氮气
20.在配制一定溶质质量分数的溶液时,正确的操作顺序是·································· 【 】
A.计算、称量、量取、溶解 B.溶解、称量、量取、计算
C.计算、溶解、称量、量取 D.溶解、计算、称量、量取
21.t℃时,向饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是····· 【 】
A.仍为饱和溶液 B.溶质的质量变小
C.溶质的溶解度不变 D.溶质的质量分数不变
22.有20g氢气和氧气的混合气体,点燃爆炸后得到18g水,氧气已经完全反应,则原混合气体中氢气的质量可能为····························································································································· 【 】
A.8 g B.4 g C.16 g D.1 g
三、填空题(12分)
23.人类生命活动离不开的气态单质是____________、液态氧化物是________。空气质量指标中含量二氧化硫过多会引起__________。
24.人体中含量最多的元素与地壳中含量最多的金属元素形成的化合物的化学式__________。
25.为了延长白灯泡的使用寿命,灯泡里放有极少量的红磷。其作用是______________,
反应的化学方程式为______________________________________________________。
26.在t℃时,将某硝酸钾溶液等分成两份,一份蒸发掉10克水,有1.5克晶体析出;另一份蒸发掉15克水,有3.5克晶体析出,则t℃时硝酸钾的溶解度为__________克/100克水。
 27.医疗上常用的生理盐水是质量分数为0.9%(密度约为1g/cm3)的氯化钠溶液。500ml的这种生理盐水中含氯化钠_______g,水______g。
27.医疗上常用的生理盐水是质量分数为0.9%(密度约为1g/cm3)的氯化钠溶液。500ml的这种生理盐水中含氯化钠_______g,水______g。
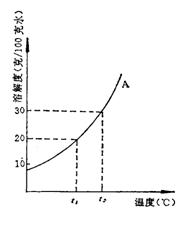
28.右图是固体A的溶解度曲线图
(1)把6克固体A放入_________克水中恰好形成t2℃时的饱和溶液。
(2)t1℃时在30克A的饱和溶液中含有_________克水。
(3)向60克含A的溶液中加入5克固体A后恰好形成t2℃时A的饱和溶液,则原溶液中含溶质A________克。
四、推断题(每格1分,本大题共9分,化学方程式每个2分)
29.有A、B、C、D、四种单质,通常状况下A、D是无色气体,B是红色金属,C是黑色粉末,现在进行下列实验:① 在D中加热B,生成一种黑色的固体物质;② C与①的生成物混合,高温下得到B和一种无色气体;③ 向①的生成物中通入气体A并加热,得到B和水。
(1)依据以上述实验,试推断这四种物质(用化学式回答):
A____________,B_____________,C______________,D______________。
(2)写出有关反应的三个化学方程式,__________________________________________。
_____________________________________,______________________________________。
五、实验题(26分,化学方程式每个2分)
30.下图是实验室用氯酸钾制氧气的装置,图中是否有错误,如有错误,指出错在哪里,并加以改正。
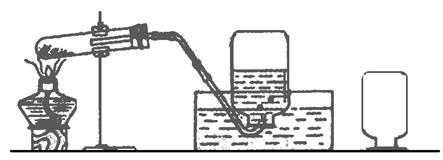
错误 改正
(1)________________________________, ________________________________。
(2)________________________________, ________________________________。
(3)________________________________, ________________________________。
(4)________________________________, ________________________________。
(5)________________________________, ________________________________。
31.长期暴露在空气中的生石灰(氧化钙)可能发生变质,部分生成碳酸钙。某同学想了解生石灰的有关化学性质和变质情况,设计了如下实验:
| 步骤 | 现象 | 结论或化学方程式 |
| 1、取少量样品放入水中,充分搅拌后过滤,在滤液中滴入酚酞试液。 | 酚酞变红 | 写出氧化钙和水反应的化学方程式: _________________________________________ |
| 2、在过滤后的滤渣中,滴加盐酸。 | 有气泡产生 | 写出产生气体的有关化学方程式: _________________________________________ 生石灰________(填“是”或“没有”)变质。 |
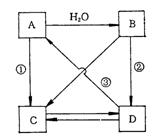 32.A、B、C、D是四种含钙化合物,它们之间的变化关系如图所示。已知A、D是白色固体,B是悬浊液,C是溶液,C能跟硝酸银溶液反应生成白色沉淀。试填充:
32.A、B、C、D是四种含钙化合物,它们之间的变化关系如图所示。已知A、D是白色固体,B是悬浊液,C是溶液,C能跟硝酸银溶液反应生成白色沉淀。试填充:
(1)写出A、B、C、D的化学式。
A______________B______________C______________D______________
(2)反应①所加的试剂是_________,反应②所加的试剂是________反应③的条件是_________。
(3)写出下列变化的化学方程式。
D![]() C:________________________________________________________________________
C:________________________________________________________________________
B![]() D:________________________________________________________________________
D:________________________________________________________________________
六、计算题(10分)
33.把25克含杂质20%的石灰石放人100克稀盐酸中,充分反应(假设盐酸足量,且杂质不溶于水,也不能跟酸反应)。求:
(1)反应后生成二氧化碳多少克?
(2)将反应物过滤,滤液的质量是多少克?并求出生成溶液的质量分数。
34.配制368毫升浓度为49%的硫酸(密度为1.40克/厘米3),需浓度为98%的浓硫酸(密度ρ=1.84克/厘米3)多少毫升?加水多少毫升?
35.已知20℃时NaCl的溶解度为36克/100克水,请采用不同方法将100克20%的NaCl溶液变为饱和溶液(通过计算回答)。