初三化学第二学期《酸、碱、盐》综合测试卷
第Ⅰ卷(选择题,共60分)
一、选择题(本题包括10小题,每小题2分,共20分,每小题只一个选项符合题意。)
1.你认为确定一瓶标签残缺的试液是否BaCl2溶液的最佳方法是( )
A.讨论 B.实验 C.调查 D.上网
2.下列属于物理变化的是( )
A.稀盐酸使紫色石蕊试液变红 B.稀盐酸除锈
C.活性炭使红墨水褪色 D.CO2使澄清的石灰水变浑浊
3.证明氢氧化钠是否变质,可选用的试剂是( )
A.酚酞 B.石蕊 C.盐酸 D.硫酸铜
4.做馒头的面团发酵的时间太长会变酸,要除去酸味,可在面团中加入( )
A.氢氧化钠 B.氧化钠 C.碳酸钠 D.氯化钠
5.自来水生产中,常加入适量的氯气进行杀菌消毒,氯气与水反应生成物之一为盐酸。市面上有些不法商贩用自来水冒充纯净水(蒸馏水)出售。为辨别真伪,可以用下列一种试剂来鉴别( )
A.酚酞试液 B.NaCl溶液 C.NaOH溶液 D.AgNO3溶液
6.下列金属活动顺序符合从弱到强的顺序的是( )
A.Na、Mg、Al B.Hg、Ag、Fe C.Na、Ca、K D.Au、Ag、Pt
| 选项 | A | B | C | D | E | F |
| 食品 | 柠檬 | 苹果 | 香蕉 | 鸡蛋 | 西红柿 | 樱桃 |
| pH | 2.3 | 3.1 | 4.6 | 7.8 | 4.2 | 3.6 |
7.右表是常见食品的近似pH,你认为表中食品呈碱性的是( )
| 作物 | 茶 | 油菜 | 西瓜 | 甘草 |
| 最适宜的pH范围 | 4.5~5.5 | 5.8~6.7 | 6.0~7.0 | 7.2~8.5 |
8.土壤的酸碱度会影响农作物的生长,某地区土壤呈微酸性。参照右表,从土壤的酸碱性考虑,在该地区不适宜种植的作物是( )
A.茶 B.油菜 C.西瓜 D.甘草
9.用“王水”(浓盐酸与浓硝酸的混合物)溶解黄金后得到一种物质:HAuCl4(四氯合金酸),其中金元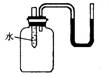 素的化合价为( )
素的化合价为( )
A.+1 B.+2 C.+3 D.+4
10.如图所示,若向小试管中分别加入一定量的下列物质,右侧U型管中的液面未发生
明显的变化,该物质应是( )
A.浓硫酸 B.食盐固体 C.氧化钙固体 D.氢氧化钠固体
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或二个选项符合题意。)
11.下列化学反应中,可能有单质生成的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
12.在滴有石蕊试液的碳酸钠溶液中,加入过量盐酸,加盐酸前后溶液的颜色依次为( )
A. 紫色、红色 B.红色、蓝色 C.红色、无色 D. 蓝色、红色
13.下列各组中的物质,只用水就能鉴别的是( )
A.固体:氯化钾、硫酸钾、硫酸钡 B.气体:氢气、氧气、二氧化碳
C.固体:碳酸钙、氯化钙、氢氧化钠 D.液体:汽油、水、浓硫酸
14.用镁和铝分别跟足量的稀硫酸反应,若要制得相同质量的氢气,则消耗掉镁和铝的质量比是( )
A.8:9 B.4:3 C.16:27 D.3:4
15.不用其它试剂鉴别下列五种物质的溶液:①H2SO4 ②FeCl3 ③Ba(OH)2 ④KCl ⑤BaCl2,被鉴别出物质的顺序是( )
A. ②①③⑤④ B.②③①⑤④ C.⑤①③②④ D.①③⑤②④
16.某学校化学兴趣小组取他们学校周围一污染的河水进行成分测定,观察河水呈无色,四组同学分别得出如下结论,其中可能正确的是( )
A.H+、Na+、Cl-、CO32- B.Na+、K+、Cu2+、Cl-
C.K+、Cl-、Mg2+、SO42- D.Ag+、NO3-、Mg2+、Cl-
17.向氯化亚铁、氯化铜的混合溶液中加入一定量的锌粉,充分反应后过滤,得到固体不溶物A和滤液,则A的组成不可能是( )
A.只含有Zn、Cu B.只含有 Fe、Cu
C.只含有Zn、Fe D.只含有Cu
18.明代爱国将领于谦的《石灰吟》:千锤万凿出深山,烈火焚烧若等闲;粉身碎骨浑不怕,要留清白在人间。该诗体现诗人的崇高情操和献身精神。诗中蕴含着石灰的来源、生产、性质、用途等多种化学事实。下列化学变化与诗意无关的是( )
A.![]() B.CaO+H2O=Ca(OH)2
B.CaO+H2O=Ca(OH)2
C.Ca(OH)2+CO2=CaCO3↓+H2O D.CaCO3+2HCl=CaCl2+H2O+CO2↑
19.一瓶密封保存的KNO3饱和溶液,当温度改变时,下列说法中,正确的是( )
A.不管升温还是降温,溶液成分都保持不变
B.温度升高,则变成不饱和溶液,溶质质量分数不变
C.温度降低,仍为饱和溶液,溶质质量分数不变
D.温度升高,溶液的溶质质量分数变小
20.在一定条件下,反应物溶液中溶质的质量分数越大,化学反应速率越快。现有50g溶质的质量分数为32%的硫酸溶液与过量的锌粉反应,为了减缓反应速率,而又不影响生成H2的总质量,可向该硫酸中加入适量的( )
A.氢氧化钾溶液 B.氯化钾溶液 C.碳酸钾溶液 D.水
一、二 选择题答案(请将选项代号填写在以下表格中,共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷(非选择题,共40分)
三、填空题(共30分)
21.(4分)在K2SO4溶液中,K+个数为a个,则SO42-个数为 个;在KCl和K2SO4的混合溶液中,若K+个数为a个,Cl-个数为b个,则SO42-的个数是 个。
22.(6分)下列两组物质:(甲)CO2、H2、O2、Fe; (乙)AgNO3、CuSO4、Hg(NO3)2、HCl
(1)甲组中的_________能与乙组中所有物质反应。
(2)甲乙两组物质中各有一种在物质分类上与其它三种不同,它们依次是
___ ___、_ ____。
23.(12分)已知常用的强酸(H2SO4、HCl、HNO3)跟常用的强碱(NaOH、KOH)反应生成的盐的水溶液显中性。现将某白色粉末溶入一无色中性液体中,按以下图示进行实验。
 |
试按要求推断未知物:
(1)用化学式写出:B ;C ;D 。
(2)若A是纯净物,无色中性液体也是纯净物,则中性液体是(填化学式) 。
 (3)若A是纯净物,无色中性液体是只含一种溶质的溶液,则中性液体是(填化学式)
(3)若A是纯净物,无色中性液体是只含一种溶质的溶液,则中性液体是(填化学式)
或 溶液。
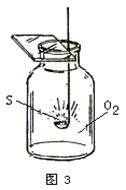
24.(8分)“绿色化学”强调采取有效措施,节约能源、防止对环境的破坏和污染。化学实验设计应该尽可能符合“绿色化学”的要求。
(1)图3实验不符合“绿色化学”要求,这是因为反应产物会
_________________ ______;
若实验前往集气瓶中加适量的NaOH溶液,再进行实验,较符合“绿色化学”要
 求,原因是________________
______
求,原因是________________
______
(用化学方程式表示)
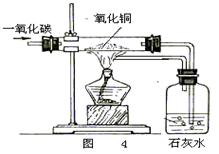
(2)图4是小强设计的CO还原CuO实验。该实验符合
“绿色化学”要求,体现在:
①_____________________ _________;
②________________________ ___________。
25.(10分)称取21.1g氢氧化钠和氢氧化钡固体混合物,配制成523.3g溶液,然后向其中加入100g硫酸钠溶液恰好完全反应;经过滤后,得到滤液和沉淀;小心烘干沉淀,得到固体23.3g(已知:Ba(OH)2+Na2SO4 = BaSO4↓+2NaOH)。 试计算:
(1)混合物中氢氧化钡的质量; (2)所得滤液中溶质的质量分数。