初三化学第二学期三月份月考试卷
(化学部分为60分)
相对原子质量:H-1,O-16,Ag-108,Cl-35.5,Na-23,N-14,Cu-64,Mg-24,Zn-65,Al-27,S-32
一、填空题:(每小格1分,共10分)
1、填写下列物质的名称或化学式,并指出所属的类别(指单质、氧化物、酸、碱、盐):
| 物质名称 | 水银 | 氢硫酸 | 胆矾 | ||
| 化学式 | Mg(OH)2 | FeCl2 | |||
| 类别 |
二、选择题:(每小题1分,共13分)
2、下列变化中,都属于物理变化的一组是------------------------------------------------ 【 】
A.铁生锈、电解水 B.石碱风化、火碱潮解
C.胆矾受热分解、浓硫酸吸水 D.浓盐酸的挥发、用二氧化碳制干冰
3、下列各组物质按单质、化合物、混合物顺序排列的是------------------------------- 【 】
A.冰、生石灰、天然气 B.金刚石、烧碱、食盐水
C.碘酒、纯碱、胆矾 D.液态氧、盐酸、沼气
4、存放下列物质时,必须密闭的是-------------------------------------------------------- 【 】
①浓H2SO4 ②Ca(OH)2固体 ③盐酸 ④硝酸钾
A.① B.①② C.①②③ D.①②③④
5、将锌片分别插入下列各溶液中,反应后的溶液质量增加的是----------------------- 【 】
①稀硫酸 ②硫酸铜 ③硝酸银 ④氯化镁
A.① B.①② C.①②③ D.④
6、根据你的生活经验判断,下列做法错误的是------------------------------------------- 【 】
A.用生石灰作食品干燥剂 B.用干冰灭火
C.涂油漆防锈 D.用燃着的火柴检验煤气是否泄露
7、用镁和铝分别跟足量的稀硫酸反应,若要制得相同质量的氢气,则消耗掉镁和铝的质量比是 【 】
A.8:9 B.4:3 C.16:27 D.3:4
8、证明氢氧化钠是否变质,可选用的试剂是--------------------------------------------- 【 】
A.酚酞 B.石蕊 C.盐酸 D.硫酸铜
9、在滴有石蕊试液的碳酸钠溶液中,加入过量盐酸,加盐酸前后溶液的颜色依次为 【 】
A.紫色、红色 B.红色、蓝色 C.蓝色、红色 D.红色、无色
10、已知某溶液中含有HCl、H2SO4和KNO3,则下列物质能存在于该溶液中的是-- 【 】
A.BaCl2 B.Na2CO3 C.MgSO4 D.NaOH
11、下列各组中的物质,只用水就能鉴别的是-------------------------------------------- 【 】
A.固体:氯化钾、硫酸钾、硫酸钡 B.气体:氢气、氧气、二氧化碳
C.固体:碳酸钙、氯化钙、氢氧化钠 D.液体:汽油、水、浓硫酸
12、在一定浓度的硫酸溶液中逐滴滴入氢氧化钡溶液直至过量,溶液的pH值与所滴入氢氧化钡溶液(用x表示)的关系,最接近下列图示的是--------------------------------------------------------------------------- 【 】
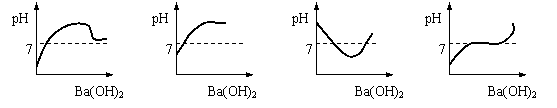 |
A. B. C. D.
13、要验证铜、银、铁三种金属的活动性顺序时,不能选用哪组物质进行实验----- 【 】
 A.银、铜、硝酸铁 B.银、铜、铁、硫酸铜
A.银、铜、硝酸铁 B.银、铜、铁、硫酸铜
C.银、铁、硫酸铜 D.铜、硝酸铁、硝酸银
14、如右图所示,在试管内盛有稀硫酸,试管口用食品袋
扎紧[不漏气],袋内放有固体,此时天平保持平衡。若将固
体放入试管内,最终出现左盘升右盘降现象,此时加入的
固体是-------------------------------------------------------------------------------------- 【 】
A.MgO B.Mg C.Cu D.Na2CO3
三、填空:(每小格1分,共15分)
15、夏天用来清凉散热、醒脑提神的清凉油,主要成分为薄菏脑(化学式C10H20O)。该物质由____________种元素组成,薄荷脑中碳、氢、氧元素的质量比_________________。
16、固体氢氧化钠要密封保存是因为它暴露在空气中会发生__________,还能与________反应而变质,该反应的化学方程式为__________________________________________。
17、今有下列物质:①盐酸,②烧碱,③熟石灰,④三氧化硫,⑤氢氧化铁,⑥硫酸铜。选择适当物质填入下列空格内(用化学式表示):
⑴可以做某些气体干燥剂的_________________,⑵其水溶液能使酚酞试液变红的是_________________、_________________,⑶有颜色的不溶物是_________________。
18、将“先”与“后”填入下列空格中:
(1) 不慎将浓硫酸沾在皮肤上:______用大量水冲洗,______用抹布拭去;
(2) 为了除去H2中混有的水蒸气和SO2,应将混合气体______通过浓H2SO4,_______通过NaOH溶液。
19、去除盐酸中混有少量的硫酸,可选用_________溶液。用熟石灰和_________为原料可以制备氢氧化钠。(用化学式表示)
20、常温下浓硫酸可用铁桶盛装。但盛过浓硫酸的铁桶用水清洗时要远离火源,用化学反应方程式表示其原因________________________________________________________。
四、实验题:(每小格1分,共17分)
21、只用一种试剂鉴别NaOH、BaCl2、Na2CO3三种溶液
| 操作 | 现象 | 结论 | 化学方程式 |
| 取上述溶液各少许分别滴入三支试管中,然后将 溶液分别滴入三支试管中。 | _____________ | NaOH | ______________________ |
| _____________ | BaCl2 | ______________________ |
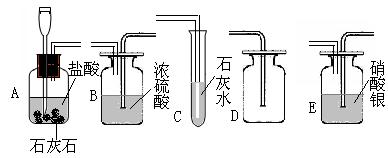
22、实验室选用下图所示装置,制取二氧化碳气体(混有氯化氢、水蒸气),并进行有关实验,请回答:
(1)如果要证明制得的气体中混有氯化氢,就把A装置与_____________装置连接,观察到的现象是_____________________,反应的化学方程式________________________________。
(2)如果要验证制得的气体是二氧化碳,应该选用下图装置_____________(填装置序号)。发生的化学反应方程式为______________________________________(填装置序号)。
23、铁暴露在空气中会生锈。不知你注意了没有,将苹果切开不久,果肉上就会产生一层咖啡色的物质,也好象是生了“锈”一样。某化学活动小组对此进行了探究。
[提出问题]:切开的苹果“生锈”与什么因素有关?
[猜想与假设]
猜想 ①:可能与空气没有关系,只是果肉内的物质自身相互反应而“生锈”。
猜想 ②:可能是果肉中的物质与空气中的氧气作用而“生锈”。
猜想 ③:可能是果肉中的物质与空气中的氮气作用而“生锈”。
猜想 ④:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”。
猜想 ⑤:可能是果肉中的物质与空气中的氧气作用而“生锈”,并且苹果“生锈”的速度还可能与温度有关。
[收集证据] (一)、查找有关资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生反应,生成咖啡色的物质。
(二)、实验探究:针对上面的猜想①到⑤,化学活动小组依次设计了实验方案,进行了实验验证,并依次观察到下列实验现象。请你将他们设计的可行的实验探究方案,填写在下表中。
| 猜想 | 可行的实验方案 | 观察到的实验现象 |
| 猜想① | 将一小块果肉浸入盛有蒸馏水的烧杯中,观察现象。 | 果肉表面不变色。 |
| 猜想② | 果肉表面变色。 | |
| 猜想③ | 果肉表面不变色。 | |
| 猜想④ | 果肉表面不变色。 | |
| 猜想⑤ | 温度高的先变色。 |
[得出结论]:_______________________________________________________________。(2分)
[反思与评价]:在②到⑤四种猜想中,你认为猜想_________________(填代号)最不合理,理由是____________________________________________________________________。
五、计算题:(共6分)
24、在200C,20克CuSO4饱和溶液跟20克10%的NaOH溶液恰好完全反应。
(1) 求硫酸铜溶液中所含溶质的质量。(2分)
(2) 求该温度下硫酸铜的溶解度。(2分)
(3) 求反应后溶液中溶质的质量分数(精确到0.1%)(2分)