初三化学第一学期第二次联考试卷
汪国化
本试卷可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Na—23
一、选择题(每小题只有一个正确答案。每题2分,共20分)
1.下列生活事例中,主要过程为化学变化的是:
A.功夫深,铁杵成针 B.佳节到,焰火缤纷 C.春天来,冰雪消融 D.美酒开,满屋飘香
2.聪明的小红同学在烧水时发现壶中有许多水垢[水垢的主要成分是CaCO3],
想用下列物质除去水垢,你认为可行的是
A.用水冲洗 B.用洗涤剂溶液浸泡后冲洗 C.用食盐水浸泡后冲洗 D.用食醋浸泡后冲洗
3.下列装置不能用做证明质量守恒定律实验的是
 |
4.根据右图溶解度曲线判断,下列说法不正确的是( )
A.![]() ℃时,甲的溶解度小于乙的溶解度
℃时,甲的溶解度小于乙的溶解度
B.![]() ℃时,甲、乙的饱和溶液中溶质质量分数相等
℃时,甲、乙的饱和溶液中溶质质量分数相等
C.![]() ℃时,甲、乙两物质的饱和溶液降温至
℃时,甲、乙两物质的饱和溶液降温至![]() ℃时都会析出晶体
℃时都会析出晶体
D.当甲中含有少量乙时,可采用冷却热饱和溶液结晶的方法提纯甲
5.加碘食盐中碘元素以碘酸根(![]() )的形式存在.已知在酸性条件下,
)的形式存在.已知在酸性条件下,![]() 离子能跟碘离子(
离子能跟碘离子(![]() )
)
发生反应生成碘(![]() ),
),![]() 能使淀粉变蓝色.现提供下列试剂和生活中常见的物质:①碘化钾溶
能使淀粉变蓝色.现提供下列试剂和生活中常见的物质:①碘化钾溶
液(![]() ) ②食醋 ③食糖 ④白酒 ⑤淀粉 ⑥纯碱,通过实验要证明加碘食盐中
) ②食醋 ③食糖 ④白酒 ⑤淀粉 ⑥纯碱,通过实验要证明加碘食盐中
存在![]() 离子,必须选用的试剂和物质是( )
离子,必须选用的试剂和物质是( )
A.①⑤⑥ B.①②③ C.①②⑤ D.②④⑥
6.下表列出了不同温度下每立方厘米活性炭所能吸附的常见气体的体积.分析表中数据与气体组成、
性质等的关系,你认为下列结论正确的是( )
|
|
|
|
|
| |
| 气体的沸点(℃) | -252 | -78 | -183 | -196 | -34 |
| 被吸附的体积(mL) | 4.5 | 97 | 35 | 11 | 494 |
A.气体分子所含原子个数多时,气体易被吸附 B.沸点越低的气体,越易被吸附
C.气体是化合物时,易被吸附 D.气体的相对分子质量越大,越易被吸附
7.芜湖铁画是中国工艺美术百花园中的一朵奇葩,至今已有三百多年历史。下列关于铁画的叙述
不正确的是
A生锈时主要生成四氧化三铁 B.悬挂在干燥的环境中
C.经常清扫表面的灰尘可以防止生锈 D. 表面涂漆以防止生锈
8.下列实验操作不正确的是
 | |||||||
 | |||||||
 | |||||||
 | |||||||
A B C D
9. 《科学》杂志评出2004年十大科技突破,其中“火星上找到水的影子”名列第一。
这一科技突破与下列关于水的说法联系最密切的是( )
A生命的孕育与维系需要水 B.水有固体、液体、气体三种状态
C.电解水生成氢气和氧气 D.水是化合物
10.化学现象中有许多“相等”,下列有关“相等”的说法,错误的是( )
A.原子中核内质子数和核外电子数一定相等 B. 化学反应前后,固体体总质量一定相等
C.溶液稀释前后溶质的质量一定相等 D. 化学变化前后,质量总和一定相等
| 答题卡 | 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
二、填空、简答题(共34分)
11.(7分)下图是同学们经常使用的铅笔,在组成铅笔的各种材料中:

(1) (每空填一种即可,填序号)能导电的是___________,含有单质的是_________,
含有机物的是________,燃烧时产物中有二氧化碳的是_______ 。
(5)该铅笔中④的主要成分是金属铝,将一小片该金属放入稀盐酸中,观察到的现象是
________________,反应的化学方程式是_________________________________。
12.小丽非常喜欢学习化学,并乐于活用化学知识。请你试着和小丽一起去体会活用化学知识的快乐。
(1)小丽放学一进家门就闻到了饭菜的香味,这证实了分子________________的性质。
(2)小丽注意到汽水在没有开盖以前几乎看不到有气泡,但打开瓶盖之后却有大量气泡冒出,
这说明了气体的溶解度________________________________。
(3)小丽经常帮妈妈洗碗,她每次都能很容易地把“油乎乎”的菜盘洗干净。请你猜猜看,
她可能在水中加了什么。_________________________________
13.实验室摆放着如下一排仪器;
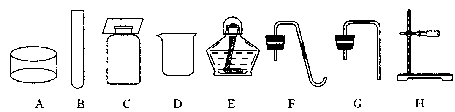
(1)仪器E的名称是______________,使用该仪器时应当注意(写一条即可):
__________________________________,可以用它直接加热的仪器是(填序号)________。
(2)你认为利用上面给出的这些仪器能制取哪些气体(写一种即可)_________。
假如小红在实验室中利用上述仪器中的A,B,C,F,H去制取某种气体,你猜她想制取的气体是
(写一种即可)____________________。
14. (2005-11-14长春综合讯)中国石油吉林石化公司双苯厂(又称101厂)装置昨天下午发生
爆炸并且起火,造成70人受伤,6人失踪,数万人要疏散。 经过初步调查,爆炸事故原因为:
苯胺装置T-102塔发生堵塞,循环不畅,因处理不当,发生爆炸,约有100吨左右的苯类污染物
(苯、苯胺、硝基苯等物质)进入了松花江水体。直接威胁沿江下游各城市生活用水(自来水大
多是从松花江中取水的)。
哈尔滨市副市长王世华昨天也说,,为保证供水,自来水厂现需要1400吨活性炭,目前已筹集
到700吨,但仍相差700吨,急需国内外支援。
“随着江水下泻、沉降与吸附作用,污染物的浓度已经显著降低。” 11月20日至22日污水团流
经黑龙江肇源断面时,硝基苯和苯最大超标倍数分别为29.9倍和2.6倍。流经下游三站断面时,
硝基苯和苯最大超标倍数分别为3.8倍和0.08倍。
(1)苯是一种有机化合物,化学式为C6H6 , 由C6H6 你能得到哪些信息?请写三条:
______________________ ; ______________________ ; _______________________
(2)为保证自来水供应,哈尔滨为什么需要流行性炭?_______________________________
(3)污水从松花江的上游肇源到三站,硝基苯和苯超标倍数为什么会下降?(写出一点即可)
__________________________
(4)你对这次水污染事件有何看法或想法?__________________________
(附:从江中取水生产自来水的流程图)
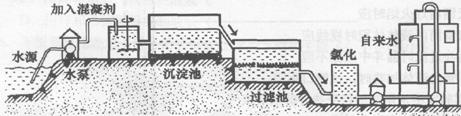 |
 15.右图是市场上销售的充气包装的食品,它使用的
15.右图是市场上销售的充气包装的食品,它使用的
是什么气体呢?某兴趣小组对此进行了研究。
经访问有关人员,了解到这样包装的目的是为了防止食品
挤压变形或食品腐烂,且从经济性、环保等因素考虑,工厂使用的包装气体是空气或空气的成分之一。
请你以此调查结果为依据,对包装气体的成分提出一种猜想,并说明你猜想的依据。
| 猜 想 | 猜 想 | 猜 想 | |
| 我对气体的猜想是 | |||
| 我猜想的依据是 |
(2)请设计实验,检验上述一种猜想的正确性,填写下列实验报告。
| 实验方法与操作 | 可能观察到的现象及结论 |
(3)从获得气体的难易和经济性考虑,若只是为了防止食品挤压变形,最好使用的气体是__________。
16.“用双氧水和二氧化锰制氧气”的反应方程式为H2O2
![]() H2 ↑+O2 ↑某同学做了该实验后,
H2 ↑+O2 ↑某同学做了该实验后,
展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次
收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎样影响的呢?
答: 。(2分)
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行
实验。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540mL气体时所用时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度(℃) | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响呢?如果有,是怎样影响的呢?答: 。
由表中数据还可看出,该反应是个 反应(填“放热”或“吸热”)。
(3) 还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想: 。
三、 本大题共6分
17.2005年5月22日,中国登山测量队成功登上珠峰峰顶,圆满完成珠峰高度最新测量工作。
登山队员常用的能源是氢化钙(CaH2)固体,用它和水反应生成氢氧化钙和氢气
[CaH2+2H2O=Ca(OH)2+2H2↑],氢气供燃烧之需。请回答下列问题:
(1)CaH2中钙元素为+2价,氢元素的化合价为_______。
(2)现有875g氢化钙固体(含CaH2 96%),与足量水反应可生成多少克氢气?