溶解现象练习
测试时间 45 分钟 班级 姓名 得分
一、三思而选(每小题只有一个选项是正确的,3分×10=30分)
1.在一定温度下,将少量生石灰放入一定量的饱和石灰水中,搅拌并冷却到原来的温度,下列说法正确的是 ( )
A.溶剂质量不变 B.溶质质量增加
C.溶液浓度不变 D.溶解度增大
2.在25℃时,向足量的硝酸钾饱和溶液中入16g硝酸钾粉末,搅拌后静置,最终所得晶体的质量( )
A.等于16g B.等于25g C.大于16g而小于25g D.大于25g
3.某温度时,KNO3饱和溶液的溶质质量分数为20%,则该温度时KNO3的溶解度是( )
A.20g B.25g C.30g D.40g
4.溶液在稀释前后保持不变的是 ( )
A.溶质的质量分数 B.溶质的质量
C.溶液的质量 D.溶剂的质量
5.20℃时,NaC1的溶解度为36g,向100gNaC1饱和溶液中加5克食盐晶体后,溶液在温度不变的条件下,其溶液的质量分数为 ( )
A.25% B.26.5% C.29.5% D.30%
6.现有一杯20℃时的Ca(OH)2饱和溶液,在下列情况下,溶液中溶质的质量分数不变的是 ( )
A.温度不变,往溶液中加蒸馏水
B.温度不变,往溶液中加入Ca(OH)2固体
C.温度不变,往溶液吕通入CO2气体
D.温度由20℃升到50℃(忽略水的蒸发)
7.下列是关于粗盐提纯实验的几种说法,其中正确的 ( )
A.为加快过滤速度,应用玻璃不断搅拌过滤器中的液体
B.如果经两次过滤,滤液仍浑浊,则应检查实验装置并分析原因
C.蒸发滤液时,要用玻璃棒不断搅拌,用酒精灯持续加热,直到蒸干为止
D.蒸发完毕后,待其冷却,由于食盐无毒,可用手指将食盐转移到纸上称量
8.20℃时,50g水中最多溶解2.5gM物质;30℃时,80g水中最多溶解4.0gN物质,则两种物质的溶解度相比较是 ( )
A.M>N B.M<N C.M=N D.无法比较
9.t℃时的硝酸钾溶液200g蒸发20g水后,析出晶体8g,又蒸发20g水后析出晶体12g,则t℃时硝酸钾的溶解度为 ( )
A.60g B.50g C.40g D.100g
10.20时120g质量分数为15%的A物质的溶液,温度不变蒸发掉22g水后析出2g溶质,则A物质在20℃时的溶解度为 ( )
A.20g B.9g C.18g D.16g
二、有空来做做(本大题共8小题,除注明分数外,其余每空1分,共34分)
1.打开汽水瓶盖,有大量气泡从瓶口逸出,这是因为 。烧开水时,加热不久在锅底出现许多气泡,这说明 。
2.将下列溶液中溶质的化学式(碘酒写名称)填在相应的短线上。
硫酸溶液 ;澄清石灰水 ;碘酒 ;锌与盐酸反应后的溶液 ;硝酸钾溶液 。
3.把5g食盐、20g蔗糖完全溶解在100g水里,此时形成的混合物中,溶质是 ,溶剂是 ,所形成溶液的质量是 g。
4.澄清的石灰水中,溶质是 ,溶剂是 。向石灰水中通入一定量的CO2后,静置一会儿就有 (填化学式)沉淀下来,这时滴加稀盐酸,待沉淀恰好完全消失,剩余溶液中 是溶质, 是溶剂。
5.如图4-2所示是X,Y,Z三种固体物质的溶解度曲线,看图回答下列问题:
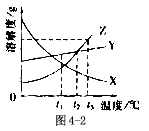 (1)t1℃时,三种物质的溶解度由大到小的顺序为
。
(1)t1℃时,三种物质的溶解度由大到小的顺序为
。
(2)在 ℃时,Y与Z溶解度相等。
(3)t3℃时,X,Y,Z的饱和溶液各Wg,冷却到t1℃,析出晶体最多的是 ,没有晶体析出的是 。
(4)要从含X,Y,Z的混合物中分离出Z,最好采用 。
6.t℃时的KNO3溶液,恒温蒸发Ag水时,析出晶体ag;再恒温蒸发Ag水双析出晶体bg(a≠b),回答下列问题:(本小题4分)
(1)a b( “>”或“<”)
(2)时KNO3的溶解度为 。
7.根据你的日常生活的经验,你能想到哪些可能影响食盐在水中的溶解速率的因素,写出其中两项,并预测此因素对食盐溶解速率的影响。
因素② ,你的预测 ,
因素① ,你的预测 。
8.(1)图4-3为a、b两种物质的溶解度曲线。t℃时,a、b两种物质的饱和溶液中溶液质的质量分数的大小关系是 ;
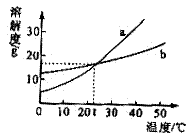 (2)温度高于t℃时,将等质量a、b的饱和溶液同时从相同的温度降至t℃,析出晶体的质量关系 是a
b(填大于、等于、小于);
(2)温度高于t℃时,将等质量a、b的饱和溶液同时从相同的温度降至t℃,析出晶体的质量关系 是a
b(填大于、等于、小于);
(3)t℃时,将接近饱和的a的溶液变成饱和溶液,若要求溶液的质量不发生改变,可采取的方法是 ;若要求溶液的温度不改变,可采取的方法是
。
|
三、简答题(本大题包括2小题,每小题4分,共8分)
1.我国的内蒙古自治区是世界上最著名的天然碱产地之一,每年的10月至来年的4月为天然碱的开采期,这时,人们砸开湖面上的冰层,深入湖底捞取“碱块”,称之为“破冰取碱”。试简要解释其中的道理。
5.天然气、液化石油气(主要成分是C3H8)燃烧的化学方程式如下所示:
CH4+2O2 = CO2+2H2O C3H8+5O2=3CO2+4H2O
现在一套以天然气为燃料的灶具,今改用液化石油气为燃料,为保证燃料充分燃烧,应采取的措施是( )
A.减少空气的进入量,增大液化石油的进入量
B.增大空气的进入量,减少液化石油气的进入量
C.增大空气的进入量,也增大液化石油气的进入量
D.同时减少空气、液化石油气的进入量
四、综合题(共6分)
两瓶试剂瓶中分别盛放蒸馏水和食盐溶液,试分别用物理、化学、生物方法分别鉴别出来。
五、探究题(本大题共8分)
在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要使其他因素保持不变,以探究此种因素对实验结果的影响。
完成实验探究:哪些因素影响固体物质在水中的溶解度?
因素1:溶质的种类
在实验中要改变的因素是:溶质的种类
要保持不变的因素是:温度
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③3支试管中,再分别加入NaC1、KNO3、Ca(OH)2TK 2g,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量NaC1未溶,试管②中KNO3全部溶解,试管③中有多量Ca(OH)2未溶。
实验结论:在 保持不变的情况下,不同种类固体物质在水里的溶解度
(填“相等”或“不相等”);
因素2:温度(以KNO3为例)
在实验中要改变的因素是:
要保持不变的因素是:溶质的种类(KNO3)
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③3支试管中,再各加入5Gkno3晶体,将试管①保持在常温下,将试管②加热并保持在40℃,将试管③加热并保持在60℃,振荡,观察各试管中KNO3的溶解情况。
实验现象:试管①中有多量KNO3未溶,试管②中有少量KNO3未溶,试管③中KNO3 全部溶解。
实验结论:在不同温度下,固体、物质(KNO3)在水里的溶解度 (填“相等”或“不相等”)。
六、计算题(第1小题5分,第2小题9分,共14分)
1.在农业生产上,有时用质量分数为10%—20%的食盐溶液来选种。现有NaC1质量分数为30%的食盐水60g,与NaC1质量分数为10%的溶液混合来配制溶液中NaC1质量分数为15%的选种液,则配制这样的选种液需NaC1质量分数为10%的食盐溶液多少克?
2.现有20%的硝酸钾溶液,2%的硝酸钾溶液,硝酸钾固体和水。请选用上述不同物质配制10%的硝酸钾溶液,将用量的最简整数比填入下表相应的位置。
|
| 20%硝酸钾溶液 | 2%硝酸钾溶液 | 硝酸钾固体 | 水 |
| 示 例 | 4 | 7 | ||
| 方案1 | ||||
| 方案2 | ||||
| 方案3 |
专题四 参考答案
反三新活题训练A: 1.C 2.D 3.D
反三新活题训练B: 1.B 2.A 3.D
反三新活题训练C: 1.B 2.C 3.A
化学新课标活题测试卷四
一、1.C 2.D 3.B 4.B 5.B 6.B 7.B 8.D 9.A 10.A
二、1. 对于CO2来说,压强减小,溶解度变小,因此有气泡逸出 气体物质的溶解度随着温度的升高而减小。
2. H2S4 Ca(OH)2 碘(I2) ZnC12 KNO3
3. 食盐和蔗糖 水 125
4. Ca(OH)2 水 CaCO3 H2O
5. (1)Y>X>Z (2)t2 (3)Z X
|
|
7.①温度 温度升高(或降低)食盐溶解加快或减慢
②晶体颗粒大小 食盐颗粒越小,溶解越快(说明,其他合理答案亦可给分)
8.(1)a=b (2)大于 (3)降低温度 (4)加入a物质
三、1.天然碱的溶解度随温度降低而减小,冬天(10月至来年4月),湖水温度降低,天然碱的溶解度变小,大量碱从湖中析出,人们可以从湖底捞取“碱块”。
2.这两个实验说明:在升高温度或增加溶剂量的情况下,原来的饱和溶液可转化为不饱和溶液。
四、从物理角度考虑鉴别的方法有:天平称量法、天平平衡法、密度测定法、浮力在小比较法、导电性能比较法。从化学的角度考虑鉴别的方法有:溶质溶解法(饱和食盐水中不能再溶解食盐了)、AgNO3溶液试验法、蒸发溶剂法。从生物角度考虑鉴别的方法有:味道品尝法、植物失水比较法。1
五、(1)温度,不相等 (2)温度,不相等
六、1.解:设需10%的食盐溶液质量为X
60g×30%+X×10%=(60g+X)×15%
解得X=180g
2.硝酸钾固体:水=1:9
20%硝酸钾溶液:水=1:1
2%硝酸钾溶液:硝酸钾固体=45:4