2004-2005学年上学期期末考试
九年级化学试题
可能用到的相对原子质量:H—1 O—16 K—39 Cl—35.5 Mn—55 C—12
答题说明:请将所有试题的答案都写在答题纸上,交卷时只交答题纸。
一、选择题(共5小题,每题只有一个正确答案,每小题3分,共45分)
l、下列变化不属于化学变化的是
A.燃烧
B.食物腐败
C.湿衣服经太阳晒后变干 D.钢铁生锈
2、空气中含量较多且性质不活泼的气体是
A.氧气 B.氮气 C.二氧化碳 D.水蒸气
 3、
3、
4、 下列物质中,属于纯净物的是
A.洗衣粉 B.蒸馏水 C.酸奶 D. 含氟牙膏
5、盛放酒精的包装盒上,应该有警示标记的是 ( )



A. B. C. D.
6、在我们的日常生活中出现了“加碘食盐”、“高钙牛奶”等商品。这里的“碘”、“钙”应理解为
A.元素 B.单质 C.分子 D.氧化物
7、在原子里质子数等于
A.中子数 B.电子数
C.中子数和电子数之和 D.中子数和电子数之差
8、空气质量已引起人们的广泛关注,因此目前许多地方都有空气质量预报,预报的内容
包括污染指数、首要污染物和环境空气质量等。如果从对人体健康的危害来看,在空气质量预报中,你认为下列哪项指数一般可不作预报
A.一氧化氮 B.二氧化硫
C.二氧化碳 D.可吸入颗粒物
9、美国铱星公司原计划发射77颗卫星,以实现全球卫星通讯,其要发射卫星的数目恰好与铱元素(Ir)的原子核外电子数目相等。下列关于铱元素的各种说法中正确的是 A.铱原子的质子数为70
B.铱原子的相对原子质量为77
C.铱原子的核电荷数为77 D.铱元素为非金属元素
10、下列各叙述中,错误的是
A.化学反应前后,物质的质量总和相同
B.化学反应前后,元素的种类相同
C.化学反应前后,各种原子的总数相同
D.化学反应前后,物质的分子个数相同
11、我国科学家发现,用含硒(Se)化合物——亚硒酸钠能消除掉加速人体衰老的活性氧,亚硒酸钠中的硒元素为+4价,氧元素为-2价,则亚硒酸钠的化学式为
A.Na2SeO3
B. Na2SeO4
 C.NaSeO3
D. Na2SeO2
C.NaSeO3
D. Na2SeO2
12、某老师在引导学生理解固体、液体和气体的微观结构时,带领学生做游戏,用人群的状态类比物体的状态。下图所示①、②、③三种情景分别对应的是
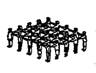

① ② ③
A.固体、气体、液体 B.气体、固体、液体
C.固体、液体、气体 D.液体、气体、固体
13、2004年我国发生多起矿井爆炸事故,带来了巨大的生命财产损失。爆炸的主要原因是井道中的某种气体与空气混合后,碰到了火花被点燃而发生的。该气体是
A.氧气
B.氮气
C.甲烷
D.二氧化碳
14、下列实验操作不正确的是
A、倾倒试剂时标签朝着手心
B、称量固体药品时,将砝码放在天平的右盘
C、观察液体体积时,视线与量筒内液体的凹液面最低处保持水平
D、熄灭燃着的酒精灯时,用嘴吹灭灯焰
15、我国江西景德镇生产的瓷器在世界上享有盛誉,瓷器主要成份为Al2(Si2O5)(OH)4则化学式中氢元素与氧元素的质量比为
A.1:4
B.1:24 C.1:36 D.2:129
二、填空题(本题包括7小题,除每个化学方程式2分外,其余每空1分,共34分。)
16、(4分)(1)请按要求写出下列常见物质的化学式:
水 , 氧化铜 ,酒精 ;
![]()
![]() (2)已知氮、硅原子结构示意图依次为:N 、Si 。氮化硅是
(2)已知氮、硅原子结构示意图依次为:N 、Si 。氮化硅是
一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等。试写出氮化硅的化学式 。
17、(4分)写出下列反应的化学方程式:
(1)实验室制取二氧化碳 ;
(2)纳米材料和纳米技术的应用,几乎涉及到各个领域。“纳米材料”特指粒子直径为1~100nm(1nm=10-9m)的颗粒,将物质的粒子直径加工至上述范围,会表现出许多特殊的性质。例如:将铝粉加工至纳米材料范围,这种铝粉在常温下遇到空气便可爆炸,写出该反应的化学方程式 。
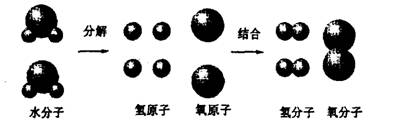 18、(4分)下图是电解水中水分子分解过程示意图。从中,能得出一些微观的规律或结论。
18、(4分)下图是电解水中水分子分解过程示意图。从中,能得出一些微观的规律或结论。
下列叙述中,有哪些能正确代表这些微观的规律或结论的?请选出它们的序号填空: 、 、 、 。
①.每个水分子由两个氢原子和一个氧原子构成的;②.每两个氢元素构成—个氢分子;③.水通电时,水分子分解成氢原子和氧原子;④.水是由氢、氧两种元素组成的;⑤.原子是化学变化中的最小粒子;⑥.分子是保持物质化学性质的最小粒子。⑦.分解前后的总质量不变。
19、(8分)十八世纪六十年代,英国化学家卡文迪许在实验室用金属锌和稀盐酸制得氢气和氯化锌,并用排水的方法收集到了氢气。初期,氢气被用于飞艇和载人气球。后因失火、爆炸等原因,人们改用氦气填充飞艇。后来,工业上主要用它来和氮气反应制取氨气(NH3);还可以用来制备金属,例如用氧化铜和氢气加热得到水和金属铜。研究发现,氢气燃烧时放出大量热,是等质量汽油燃烧放热的3倍;氢气燃烧后的产物是水,不会造成污染。因此,氢气将成为最有前景的能源。目前,工业上人们常用水和高温的焦炭(C)反应制得氢气和一氧化碳。
(1)通过学习知道,物质的性质决定物质的应用,如上介绍了一些氢气的应用知识,请在表中写出相对应的氢气的性质。(用简要的文字表述)
| 氢气的性质的应用 | 氢气对应的性质 |
| 1)用排水的方法收集氢气 | |
| 2)氢气被用于飞艇和载人气球 | |
| 3)氢气用来制金属铜 | |
| 4)氢气将成为最有前景的能源 |
(2)上述文中分别介绍了氢气的一种实验室制法和一种工业制法,请写出它们相应的化学方程式。
1)实验室制法:
;
2)工业制法: 。
20、(4分)在“铁钉跟硫酸铜溶液反应前后质量的测定”的实验中,在100 mL烧杯中加入30 mL稀硫酸铜溶液,将几根铁钉用砂纸打磨干净,将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量m1。将铁钉浸到硫酸铜溶液中,观察实验现象。待溶液颜色不再改变时,将盛有硫酸铜溶液和铁钉的烧杯放在托盘天平上称量,记录所称的质量m2。比较反应前后的质量,发现天平的读数不变,即m1= m2。
通过此实验,你可以观察到哪些现象,以及得到哪些结论? 请列出四条来。
(提示: Fe + CuSO4 = Cu + FeSO4 )
(1)现象: ①. ;
②. ;
(2)结论: ①. ;
②. 。
21、(6分)在用如右图装置“测定空气里氧气含量”的实验中,在集气瓶内加入少量水,并做上记号。用弹簧夹夹紧乳胶管。点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧。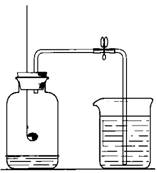 观察红磷燃烧的现象。待红磷熄灭并冷却后,打开弹簧夹,观察实验现象及水面的变化情况。
观察红磷燃烧的现象。待红磷熄灭并冷却后,打开弹簧夹,观察实验现象及水面的变化情况。
(1)、除了观察到进入集气瓶中的水约占瓶容积(加入少量
水以后的)的1/5以外,还可以观察到什么现象?①
,② 。
(2)、实验结束后,如果观察到进入的水的体积明显少于1/5,
请分析可能的原因,请说出一种原因来。 。
(3)、实验结束后,如果观察到进入的水的体积明显多于1/5,请分析可能的一种原因 。
(4)、写出红磷燃烧的化学方程式: 。
22、(4分)据报道,在“绿色武汉”的行动计划中,逐步实施了环城森林生态工程、川气入汉工程、公交车“油改气”等工程,关于上述工程有以下信息:
信息①:专家说,环城森林生态工程建成后,每年将吸收二氧化碳1.2万吨,吸收粉尘20万吨,生产氧气57万吨。
信息②:目前,武汉市当前能源结构中,煤炭使用量最大,约占40%。煤炭燃烧后,每年向天空排放二氧化硫12.4万吨,形成环境污染。今后,天然气将逐渐取代煤炭成为武汉能源市场主角。预计至2009年,全市天然气气化率达到80%。届时,仅工业“煤改气”一项,一年可以减少近6万吨二氧化硫的排放。
信息③:专家估计,如果武汉市公交车都改烧天然气,可有效降低尾气排放及噪音污染,其中一氧化碳可减少90%以上,噪音可降低40%。
根据上述信息回答:
①.我市形成酸雨的一种主要物质是 ,与我市形成温室效应有关的一种物质是
。
②.从化学的角度分析,环城生态森林工程的作用是 。
③.为了防止酸雨的形成,从生活实际出发,请你向社会提出一项合理化的倡议:
。
三、实验探究题(本题包括3小题,共15分。)
 23、(6分)小明同学欲探究“二氧化碳溶于水的过程中,有没有发生化学变化”,他按下图进行实验:取四朵用石蕊溶液染成紫色的干燥的小花。(Ⅰ)第一朵小花喷上稀醋酸;(Ⅱ)第二朵小花喷上水;(Ⅲ)第三朵小花直接放入盛满二氧化碳的集气瓶中;(Ⅳ)第四朵小花喷上水后放置一会儿,再放入盛满二氧化碳的集气瓶中。观察四朵花的颜色变化。(Ⅴ)然后将第四朵小花取出小心加热,观察现象。(提示:石蕊是一种色素,遇酸液变成红色。)
23、(6分)小明同学欲探究“二氧化碳溶于水的过程中,有没有发生化学变化”,他按下图进行实验:取四朵用石蕊溶液染成紫色的干燥的小花。(Ⅰ)第一朵小花喷上稀醋酸;(Ⅱ)第二朵小花喷上水;(Ⅲ)第三朵小花直接放入盛满二氧化碳的集气瓶中;(Ⅳ)第四朵小花喷上水后放置一会儿,再放入盛满二氧化碳的集气瓶中。观察四朵花的颜色变化。(Ⅴ)然后将第四朵小花取出小心加热,观察现象。(提示:石蕊是一种色素,遇酸液变成红色。)
请简要回答:
(1).在实验中,小明同学在观察四朵花的颜色变化时,发现(Ⅰ)、(Ⅲ)、(Ⅳ)和(Ⅴ)中花的颜色是如何变化的?请指出:(Ⅰ)、 ;(Ⅲ)、 ;
(Ⅳ)、 ;(Ⅴ)、 。
(2).小明的同学小芳研究了小明的如上实验后,她认为在(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)和(Ⅴ)这五个实验中,有一个是多余的。你同意她的观点吗? (填“同意”或“不同意”);若同意,请指出是哪一个? 。
24、(5分)李明、王芳和刘霞三位同学在一起探究蜡烛燃烧的现象时,他们将一根短玻璃导管插入焰心,发现另一端也可以点燃。
(1)[提出问题] 导管里一定有可燃性气体,气体成分可能会是什么呢?
(2)[猜 想] 李明认为:可能是蜡烛不完全燃烧时产生的CO。
王芳认为:可能是蜡烛受热后产生的蒸气。
刘霞认为:可能上述两种情况都有
(3)[设计实验方案] 他们设计了一个简单的实验方案,来判断哪一种分析是正确的:
换一根较长的导管,并用湿毛巾包住导管(起冷凝的作用),然后再在导管的另一端做点火试验。
(4)[现象与结论] 如果李明的猜想正确,现象应是
_______________________________________。
如果王芳的猜想正确,现象应是 。
如果刘霞的猜想正确,现象应是 。
(5)如果用C12H26表示该蜡烛的主要成分,它燃烧后生成水和二氧化碳,请你帮他们写出该蜡烛燃烧的化学方程式 。
25、(4分)有两瓶无色气体,一瓶是氧气,另一瓶是二氧化碳。区别它们的方法很多,请你完成下列的两种方法,并按要求填空。
| 方法 | 实 验 步 骤 | 现 象 和 结 论 |
| 方法一 | 将 分别伸入集气瓶中 | 是二氧化碳,无变化的 则是氧气。 |
| 方法二 | 将 分别倒入集气瓶中, 振荡。 | 是二氧化碳,无变化的 则是氧气。 |
三、计算题(本题包括1小题,共6分。)
26、(6分)某课外兴趣小组的同学对一批铁样品(铁中含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行了实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
|
| 甲 | 乙 | 丙 |
| 烧杯和稀硫酸的质量 | 200g | 150g | 150g |
| 加入的铁样品的质量 | 9g | 9g | 14g |
| 充分反应后,烧杯和剩余物的质量 | 208.7g | 158.7g | 163.7g |
请你认真分析表中数据,回答下列问题:
(1) 同学(填“甲、乙或丙”)所取用的稀硫酸与铁样品恰好完全反应;
(2)计算样品中铁的质量分数。
(提示:1、铁与稀硫酸反应:Fe+H2SO4 = FeSO4 + H2↑;2、计算结果精确到1%。)
2004—2005学年上学期期末调考
九年级化学试题答题纸
答题说明:请将所有试题的答案都写在答题纸上,交卷时只交答题纸。
一、选择题(本大题共有15小题,每题小题3分,共45分)
说明:请将1-15题的答案填在下表中。
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ll | l2 | 13 | 14 | l5 |
| 答案 |
二、填空题(本题包括7小题,除每个化学方程式2分外,其余每空1分,共34分。)
16、(4分)(1)水_________ , 氧化铜 ,酒精 ;
(2)氮化硅的化学式 。
17、(4分)(1) ;
(2) 。
18、(4分)请用它们的序号填空: 、 、 、 。
19、(8分)(1)
| 氢气的性质的应用 | 氢气对应的性质 |
| 1)用排水的方法收集氢气 | |
| 2)氢气被用于飞艇和载人气球 | |
| 3)氢气用来制金属铜 | |
| 4)氢气将成为最有前景的能源 |
(2)①实验室制法: ;
②工业制法: 。
20、(4分)(1)现象: ①. ;
②. 。
(2)结论: ①. ;
②. 。
21、(6分)(1)、① ,② 。
(2)、 。
(3)、 。
(4)、 。
22、(4分)(1). , 。
(2). 。
(3). 。
三、实验探究题(本题包括3小题,共15分。)
23、(6分)(1).(Ⅰ)、 ;(Ⅲ)、 ;
(Ⅳ)、 ;(Ⅴ)、 。
(2). , 。
24、(5分) (4) 。
。
。
(5) 。
25、(4分)
| 方法 | 实 验 步 骤 | 现 象 和 结 论 |
| 方法一 |
|
|
| 方法二 |
|
|
三、计算题(本题包括1小题,共6分。)
26、(6分)(提示:1、稀硫酸与铁反应:Fe+H2SO4 = FeSO4 + H2↑;2、计算结果精确到1%。)
(1) ;
(2)
解:
2004—2005学年上学期期末考试
九年级化学试卷参考答案
一、选择题(本大题共有15小题,每题小题3分,共45分)
说明:请将1-15题的答案填在下表中。
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ll | l2 | 13 | 14 | l5 |
| 答案 | C | B | B | B | C | A | B | C | C | D | A | A | C | D | C |
二、填空题(本题包括7小题,除每个化学方程式2分外,其余每空1分,共34分。)
16、(4分)(1)水:H2O , 氧化铜:CuO ,酒精:C2H5OH ;
(2)氮化硅的化学式:Si3N4 。
17、(4分)(1) CaCO3+2HCl=CaCl2+H2O+CO2↑ ;
(2) 4Al+3O2=2Al2O3 。 (不需条件,否则扣1分。)
18、(4分)请用它们的序号填空: ① 、③ 、⑤ 、⑥ 。(一个1分,不要求按顺序。)
19、(8分)(1)
| 氢气的性质的应用 | 氢气对应的性质 |
| 1)用排水的方法收集氢气 | (氢气)不溶于水 |
| 2)氢气被用于飞艇和载人气球 | (氢气)密度比空气小(小得多) |
| 3)氢气用来制金属铜 | (氢气)具有还原性(能还原氧化铜) |
| 4)氢气将成为最有前景的能源 | (氢气)具有可燃性(可燃烧,放热多) |
(2)①实验室制法: Zn+2HCl=ZnCl+H2↑;
②工业制法: C+H2O=高温=CO+H2 。
20、(4分)(1)现象: ①.铁钉表面变红(或铁钉表面有红色物质生成);
②.溶液由蓝色变浅绿色。
(2)结论: ①.反应前后质量不变等说法均可(填m1= m2不给分);
②.反应后铁钉的质量增加(或反应后溶液的质量减少)。
21、(6分)(1)、①产生大量白烟,②(燃烧)放热。(其他:产生火焰,发光等均可。)
(2)、红磷量不够、气密性不严、没等冷却打开了弹簧夹等合理一点即可。
(3)、插入时太慢而使瓶内气体膨出(或先忘了夹弹簧夹而使瓶内气体膨出)。
(4)、4P+5O2=点燃=2P2O5。
22、(4分)(1).二氧化硫(或SO2),二氧化碳(或CO2)。
(2).吸收二氧化碳,产生氧气。
(3).尽量减少含硫煤炭的燃烧(或煤炭经过脱硫后再燃烧等合理建议均可)。
三、实验探究题(本题包括3小题,共15分。)
23、(6分)(1).(Ⅰ)、变红;(Ⅲ)、颜色不变;
(Ⅳ)、放到瓶中才变红;(Ⅴ)、红色变为紫色。
(2).同意 ,(Ⅱ)(或Ⅰ,或Ⅴ)。
24、(5分) (4) 导管口能点燃,(去掉毛巾后)导管内壁看不到冷疑的固体;(1分)
导管口不能点燃,(去掉毛巾后)导管内内壁可看有到冷疑的固体;(1分)
导管口能点燃,(去掉毛巾后)导管内壁能看到冷疑的固体;(1分)
(说明:每空1分,含2个知识点,各0.5分,但本题的总分不产生0.5分。)
(5)2C28H58+85O2=点燃=56CO2+58H2O(2分)
25、(4分)
| 方法 | 实 验 步 骤 | 现 象 和 结 论 |
| 方法一 | 蘸有紫色石蕊试液的棉花或滤纸 | 紫色石蕊试液变红 |
| 方法二 | 澄清石灰水 | 石灰水变浑浊 |
三、计算题(本题包括1小题,共6分。)
26、(6分)(提示:①.稀硫酸与铁反应:Fe+H2SO4 = FeSO4 + H2↑;②.计算结果精确到1%。)
(1) 乙同学;(2分)
(2)
解:甲、乙、丙得到的氢气都是0.3g,甲、乙的9.5g铁样品已完全反应。设9.5g铁样品中含铁的质量为X,则:
Fe+H2SO4=FeSO4+H2↑
56 2
X 0.3g
56:2=X:0.3g (1分)
∴X=8.4g (1分)
∴样品中铁的质量分数为:8.4g/9.5g×100%=88.4%。 (2分)
答:略。
说明:1、所有要求书写的化学方程式,每个全对2分;化学式对,其他不全或有错给1分;化学式错不给分。
2、计算题,若思路正确,计算有误,或单位、文字表达不规范,不累计扣分,合计扣1分;其他方法若合理,参照给分。
 质 量 学生分组
质 量 学生分组