2005~2006学年度第一学期南化二中九年级化学期末测试卷
一、选择题
1.在亚硝酸盐中有一种工业用盐叫亚硝酸钠(NaNO2),我国曾多次发生将亚硝酸钠误作食盐用于烹调而引起的中毒事件。下列对亚硝酸钠的叙述不正确的是 ( )
A、 它是由钠、氮、氧三种元素组成的 B.NaNO2中氮元素的化合价为+3价
C.亚硝酸钠是由一个钠原子、一个氮原子和二个氧原子构成的 D.亚硝酸钠的相对分子质量是69
2.下列关于不一定的说法,不正确的是:
A 纯净物不一定由同种分子组成 B由同种元素组成的物质一定是单质
C 质子数相等的粒子不一定是同种元素 D 化学反应前后分子的个数不一定发生变化
3.某化合物的化学式为HnXO2n,化合价相同的X元素的氧化物的化学式是:
A XO B XO2 C X2O3 D X2O7
4.对于具有相同质子数的粒子,下列叙述正确的是:
A 一定具有相同的电子数 B一定是同种元素
C 一定是由同种元素组成的粒子 D 可能是单质,也可能是化合物
5.保持物质化学性质的粒子,肯定不包括
A 分子 B 原子 C 离子 D 电子
6.H2、CO、C分别与黑色的氧化铜反应,下列叙述中错误的是
A 反应都需要加热 B 都有红色铜生成 C 都属于置换反应 D H2、CO、C都具有还原性
7. CO、CO2在化学性质上的区别表现在
A CO2具有氧化性,CO具有还原性 B CO的密度小于CO2的密度
C CO有刺激性气味,CO2没有 D 在分子组成上,CO2比CO多一个氧原子
8.将一瓶盐酸等分成三份,分别跟等质量的铝、铁、锌反应,且剩余金属的质量为铝>铁>锌,如生成的氢气的质量分别为a、b、c,则其关系是
A a>b>c B a=b=c C c>b>a D b>c >a
9.在A+B=C+2D的反应中,9.8克A和8克的B完全反应生成14.2克的C,同时得到C的质量是:
A 1.8克 B 3.6克 C 7.2克 D 14.4克
10.在一个SO2和一个SO3中含有一样多的是:
A 硫元素 B 氧原子 C 硫原子 D 硫元素的质量分数
11. 23克的钠、24克的镁、27克的铝,分别和足量的稀硫酸反应,生成氢气的质量比是:
A 1:1:1 B 1:2:3 C 3:2:1 D 1:1:3
12.某含碳的化合物完全燃烧生成CO2和水时,消耗化合物和氧分子的个数比为1:3,则该有机物是:
A CH4 B C2H6 C C3H6 D C2H6O
13.乙醇(C2H5OH)和乙烷(C2H6)的混合气体中,氧元素的质量分数为x%,则混合物碳元素的质量分数为:
A ![]() B
B ![]() C
C ![]() D
D ![]()
14.有20.75克的两种合金粉末组成的混合物,将它投入到足量的盐酸中,充分反应后收集到1克氢气,则混合物可能是
A Fe-Zn B Zn-Cu C Mg-Al D Zn-Al
15.除去N2中含有的少量水蒸气、H2和CO2,实验操作有
① 通过浓H2SO4 ② 通过灼热的CuO ③ 通过NaOH溶液 正确的操作顺序是
A ①②③ B ③②① C ①③② D ②③①
16. 下列物质是纯净物的是:
A 净化后的空气 B 不含杂质的澄清石灰水 C 从空气中分离出来的稀有气体
D碱式碳酸铜完全分解后的固体产物
17. 某同学用量筒量取液体,初次仰视读数是19毫升,倾出部分液体后再俯视读数是11毫升,则该同学倾出的液体是:
A 8毫升 B 大于8毫升 C 小于8毫升 D 无法判断
18. 关于水的组成或构成的说法中,不正确的是:
A 由氢、氧两种元素组成 B 2个氢原子和1个氧原子构成
C由水分子构成 D每个水分子由1个氧原子和2个氢原子构成
19.有分子参加的化学反应前后,一定发生改变的是:
A 分子种类 B原子种类 C 原子个数 D相对原子质量
20.某物质R是一种环境消毒剂,可杀死空气中的SARS病毒,但如果遇到H2S气体就会失效,其反应方程式为6R+5H2S==6HCl+5SO2+2H2O,则R的化学式为( )
A、HClO B、HClO3 C、ClO2 D、Cl2O
二、填空题
1.某氮的氧化物中氮氧两元素的质量比为7:12,则此氧化物的化学式为 。
2.为检验生石灰中是否含未分解的石灰石,取一定量的粉末加入到试管中向其中加入 ,如果含石灰石则看到有 ,若将燃着的木条伸入试管口,则会看到 ,这是因为 ,其反应的化学式 。
3. R2-离子失去2个电子后,第三层比第二层少2个电子,则R2-的离子符号为 。
4.生铁中含碳量在 之间,钢中含碳量在 ,它们都属于 。
5.用化学式表示下列物质的主要成分,磁铁矿 ,赤铁矿 ,菱铁矿 。
6.铝在高温条件下 性很强,可用来还原高熔点的金属,铜在潮湿的空气中表面会生成一种
俗称 的物质,化学式 ,化学名称 。
7.非金属元素的原子最外层电子数一般 ,金属元素的原子最外层电子数一般 ,稀有气体元素的原子最外层一般有 ,通常认为这种最外层有 电子的结构,是一种 结构,元素的化学性质,跟它原子的 关系密切。
8.金属和大多数非金属单质一般是由 构成的,如铁是由 构成的;少数非金属是由
构成的,如氮气是由 构成的;共价化合物一般是由 构成的,如 ;而离子化合物由 构成的,如 。
9.铁、镁、锌、铝四种足量的金属与适量的盐酸反应后生成的H2的质量相等,则所消耗的铁、镁、锌、铝的质量比为 。
10.某同学用较浓的盐酸跟足量的碳酸钠固体反应,并将生成的气体通入澄清的石灰水中,他在较长的一段时间内为发现浑浊现象,原因是 。
11.分别用一种试剂将下列物质中混有的少量杂质除去,(括号中为杂质)
| 物 质 | 需加入的试剂或方法 | 有关化学方程式 |
| Fe粉(Fe3O4) | ||
| Cu粉(Zn粉) | ||
| CaO(CaCO3) | ||
| NaCl(Na2CO3) |
12.指出错误:2001年元月30日,位于汉江市郊区的一煤窑井突然冒出大火,将正巧路过的四人烧伤。因附近无天然气管道,不可能是管道泄漏引起的煤气爆炸,估计是窑井中产生的煤气与空气中氧气遇明火引起的爆炸。其中的错误有: 。
报导错误的原因是 。
13.要除去热水瓶胆内壁附着的水垢(主要成分是碳酸钙),可采用的方法是: ,
14.变色眼镜的玻璃片中含溴化银(AgBr),光线强时,溴化银分解为银和单质溴(Br2),眼镜自动变暗;光线弱时,单质溴与银又化合生成溴化银,眼镜片变亮。试写出上述有关的化学方程式:
、 。
15.生活中处处蕴含着化学知识,如果缺乏化学常识可能会发生事故。
(1)秸秆、煤炭、棉纱等,如果堆放不合理,空气不流通,时间长了就可能引起_________。
(2)酸雨对人类危害很大,当空气受到__________或______________的污染时,雨水便呈酸性。
(3)有一种无色的气体,吸入后就能使人大笑不止,人们常称它为“笑气”。这种气体是一种氮的氧化物,其相对分子质量为44,其中氮与氧两种元素的质量比为7:4“笑气”的化学式为___________________________。
三、实验题
1.废物利用既可节约资源,又可以保护环境。某课外兴趣小组设计了利用废旧干电池中的锌和浓硫酸以及下图所示的装置来制取干燥、纯净的氢气,并验证气体中的杂质。
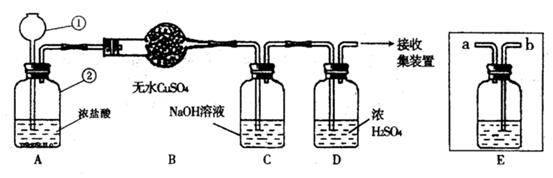
试回答下列问题:
(1)写出图中所标仪器的名称:①__________;②__________。
(2)若实验中看到B中无水硫酸铜变蓝色,这说明生产的气体中有杂质__________(填化学式)。除此之外,该气体还可能含有的杂质气体是______________(填名称),为了检验该杂质,可将E装置连接到上述装置中__________(填序号)之间,气体从__________(“a”或“b”)进入装置E,E中所放试剂为__________。
(3)装置D的作用是___________________________________________。
四、计算题
1、某石灰石厂实验室用5.55g石灰石样品高温煅烧制得生石灰和二氧化碳分析,该实验室进行了四次高温中加热,并冷却后称量,记录数据如下表(杂质不参加反应)
| 操作次数 | 1 | 2 | 3 | 4 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
计算:(1)完全反应后生成二氧化碳的质量 (2)求石灰石中碳酸钙的质量分数是多少? (3)求分析产品中生石灰的质量分数是多少?
2、某课外活动小组,为了检测本地钢铁厂生铁产品的质量,在实验室中称取生铁屑样品10g,放入烧杯中,加入一定质量的稀硫酸。加热,使之充分反应(杂质不参加反应)。然后冷却、称量。反应后烧杯中物质的质量比反应前减少了0.34g 。计算:⑴生铁样品中杂质的含量是多少g?
⑵生产100t这种生铁,至少需要含氧化铁80%的赤铁矿的质量。
参考答案:
一、选择题
1. C 2. B 3. C 4. D 5. D 6. C 7. A 8. B 9. B 10. C 11. B 12. D 13. B 14. D 15. B
16. D 17. B 18. B 19. A 20. C
二、填空题
1.N2O3 2. HCl,气泡,火焰熄灭,生成的CO2有灭火性,CaCO3 + 2HCl ==CaCl2 + CO2↑ +H2O
3.S2- 4. 2%-4.3% ,0.03%-2% ,铁合金 5.Fe3O4,Fe2O3,FeCO3
6.还原性,铜绿,Cu2(OH)2CO3,碱式碳酸铜
7.≥4,<4,8个电子,8,稳定结构,最外层电子数
8. 原子,铁原子,分子,氮气分子,分子,水,离子,氯化钠
9. 56:24:65:18
10.浓HCl有挥发性,会阻止CO2与石灰水的反应
11.
| 物 质 | 需加入的试剂或方法 | 有关化学方程式 |
| Fe粉(Fe3O4) | CO | 高温 Fe3O4 + 4CO == 3Fe + 4CO2↑ |
| Cu粉(Zn粉) | HCl | Zn +2HCl== ZnCl2 + H2↑ |
| CaO(CaCO3) | 加热 | 高温 CaCO3===CaO + CO2↑ |
| NaCl(Na2CO3) | 适量HCl | Na2CO3 +2HCl== 2NaCl+CO2↑ |
12.误将天然气说成煤气,缺乏化学常识
13.加足量盐酸
14. 2AgBr ![]() 2Ag + Br2;2Ag + Br2 ==== 2AgBr
2Ag + Br2;2Ag + Br2 ==== 2AgBr
15. (1)自燃 (2)SO2,NO2 (3)N2O
三、实验题
1.(1)①长颈漏斗 ②广口瓶
(2)H2O 二氧化硫气体 B、C b NaOH
(3)除去氢气中的水蒸气
四、计算题
1. 2.2克,5克,90.1%
2. 9.52克,170吨