| 知识梳理(一)06.5.25 | ||||
| 漯河市实验中学 | ||||
| 俗名、学名、颜色、化学式及分类 | ||||
|
| 俗名及分类 | 学名 | 化学式 | 颜色 |
| 1 | 铜绿---纯净物 | 碱式碳酸铜 | Cu2(OH)2CO3 | 浅绿色 |
| 2 | 纯碱---纯净物 | 碳酸钠 | Na2CO3 | 白色 |
| 3 | 食盐---混合物 | 氯化钠 | NaCl | 白色 |
| 4 | 胆矾、蓝矾---纯净物 | 五水硫酸铜 | CuSO4•5H2O | 蓝色 |
| 5 | 大理石、石灰石---混合物 | 碳酸钙 | CaCO3 | 白色 |
| 6 | 生石灰---纯净物 | 氧化钙 | CaO | 白色 |
| 7 | 熟石灰、消石灰---纯净物 | 氢氧化钙 | Ca(OH)2 | 白色 |
| 8 | 石灰浆、石灰水---混合物 | 氢氧化钙 | Ca(OH)2 |
|
| 9 | 烧碱、火碱、苛性钠---纯净物 | 氢氧化钠 | NaOH | 白色 |
| 10 | 酒精---纯净物 | 乙醇 | C2H5OH | 无色液体 |
| 11 | 醋酸、---纯净物 | 乙酸 | CH3COOH | 无色液体 |
| 12 | 冰醋酸---纯净物 | 乙酸 | CH3COOH | 白色固体 |
| 13 | 天然气、沼气---混合物 | 甲烷 | CH4 | 无色气体 |
| 14 | 水煤气---混合物 |
| CO、H2 | 无色气体 |
| 15 | 干冰---纯净物 | 二氧化碳 | CO2 | 白色固体 |
| 16 | 蒸馏水、---纯净物 | 水 | H2O | 无色液体 |
| 冰---纯净物 | 无色固体 | |||
| 水蒸气---纯净物 | 无色气体 | |||
| 17 | 铁锈---混合物 | 氧化铁 | Fe2O3 | 红色固体 |
| 18 | 草木灰---混合物 | 碳酸钾 | K2CO3 | 白色 |
| 19 | 盐酸---混合物 | 氢氯酸 | HCl | 无色液体 |
| 20 | 波尔多液---混合物 | 硫酸铜和氢氧化钙 |
| |
知识梳理(二)(06.5.27)
为化学预赛、复赛整理
1.“绿色化学工艺”是预防污染的手段,其理想状态是反应物里的原子全部转化到欲制取的产物中。下列反应类型中,一定属于“绿色化学工艺”的是--------( )
A 置换反应 B 化合反应 C 分解反应 D 复分解反应
2.从人类利用金属的历史来看。先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,这个先后顺序跟下列因素有关的是--------( )
① 地壳中金属元素的含量 ② 金属活动性顺序 ③ 金属的导电性
④ 金属冶炼的难易程度 ⑤ 金属的延展性
A ①③ B ②⑤ C ③⑤ D ②④
3.“厨房化学”可理解为利用家庭生活用品来做化学实验,对化学进行学习和探究的活动。下列实验不能在“厨房化学”中完成的是 -----( )
A 探究铁制品在什么条件下易生锈 B 蛋壳能否溶于酸
C 鉴别食盐和纯碱 D 检验自来水是否含氯离子
4.下列几种溶液久置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加的是------( )
A 浓硫酸 B 浓盐酸 C 浓硝酸 D 石灰水
5.下列操作能使溶液的pH显著降低的是-----( )
A 向Na2SO4 溶液中加入BaCl2溶液 B 向H2SO4 溶液中加入NaOH
C 向澄清石灰水中加入稀盐酸 D 向BaCl2溶液中加入NaCl溶液
6.La(镧)是一种活动性比锌还强的金属元素,它的氧化物La2O3所对应的碱La(OH)3难溶于水,而LaCl3、La(NO3)3都溶于水。下列各组物质能直接反应制得LaCl3的是( )
A La与盐酸 B La2O3与 AgCl C La(OH)3与 MgCl2 D BaCl2与 La(NO3)3
 7.已知完全中和一定量的某稀盐酸需ag质量分数为4%的NaOH溶液,若改用ag质量分数为4%的KOH溶液,则反应后溶液的PH----( )
7.已知完全中和一定量的某稀盐酸需ag质量分数为4%的NaOH溶液,若改用ag质量分数为4%的KOH溶液,则反应后溶液的PH----( )
A 大于7 B 小于7 C 等于7 D 无法确定
8.如图所示,向该装置中慢慢加入X,可观察到
气球逐渐膨胀,再慢慢加入Y,又看到气球逐渐变小,X 、Y分别为-----( )
A 盐酸、硫酸铜溶液 B 盐酸、氯化钙溶液
C 硫酸、氢氧化钡溶液 D 硫酸,氯化镁溶液
9.已知置换反应:A + B → C + D
⑴ 若D为氢气,B为稀硫酸,则A的选择应满足的条件是
⑵ 若D为铜,化合物B的物质类别可能为 (填“酸”“盐”或“氧化物”)
10.谋课外活动小组为了对“蜡烛燃烧前后各物质质量之和是否会发生变化”的问题进行探究,设计了实验探究的一般步骤,请补充完整。
⑴ 提出假设:
⑵ 收集、整理资料:① 蜡烛燃烧需要氧气,生成二氧化碳和水 ;② 氧气、二氧化碳等为气体;③ 实验必须在密闭容器中进行。
⑶ 设计并进行实验:
⑷ 分析现象并得出结论:
11.某化学课外活动小组设计实验验证某管道煤气的成分。首先将混合气体通过足量的生石灰和固体烧碱的混合物,除去其中的二氧化碳和水蒸气,接着进行了以下实验,请根据实验的推断结果,填写实验步骤和实验现象。
| 实验步骤 | 实验现象 | 推断结果 |
| 可能有中的一种或两种H2、CO | ||
| 肯定有H2 | ||
| 肯定有CO |
12.请设计实验,证明三氧化二铁能加快氯酸钾的化学反应速率。
| 实验步骤 | 观察到的主要现象及结论 |
13.已知Cu2O是一种红色的固体物质,在酸性溶液中,可发生反应生成Cu2+和Cu。请用已学过的知识设计一个最简便的实验方案,检验CuO经氢气还原所得到的红色产物中是否有Cu2O。
| 实验步骤 | |
| 实验现象与结论 | |
| 化学方程式 |
14.现有大小相同且用玻璃片盖上的两瓶无色气体,一瓶为SO2,一瓶为H2S 。江两瓶气体口对口放置,抽去玻璃片,观察到瓶壁逐渐由淡黄色固体单质和水珠附着。请用分子的有关知识解释上述现象并写出反应的化学方程式。
知识梳理(三)化学史专题
1.在2400年前,古希腊哲学家德谟克里特在一首诗里表达了物质不灭的观点:“无中不能生有,任何存在的东西也不会消灭。看起来万物是死了,实则犹生:正如一场春雨落地,霎时失去踪影,可是草木把它吸收,生成花叶果实,——依然欣欣向荣。”请从分子和原子的观点说明物质不灭的原因。
2.化学家舍勒和普里斯特里,早在18世纪就先后独立发现了氧气,但由于受“燃素理论”的影响(即认为一切可以燃烧的物质都是有灰和“燃素”组成的,物质燃烧后剩下的是灰而燃素本身变成了光和热散逸到空气中),使他们放弃了自己的研究成果。
根据“燃素理论”推知,燃烧后的物质的质量应该减轻,但法国化学家拉瓦锡在研究以及一些金属燃烧时,作了大量的定量实验,实验结果都与“燃素理论”相违背。他大胆质疑,尊重实验事实,进行深入研究,克服重重阻力,推翻了“燃素理论”,真正发现了氧气。
请回答:⑴拉瓦锡之所以成为氧气的真正发现者,应该归于拉瓦锡具 的
科学精神。
⑵拉瓦锡推翻“燃素理论”的实验事实是 。
⑶用学过的理论揭示磷燃烧时质量的变化情况: 。
⑷写出实验室制备氧气的化学方程式: 。
⑸实验室可用 法制备氧气。
⑹用⑷⑸中的方法制备和收集氧气时,需要的玻璃仪器是 。
3.我国古代有“女娲补天”的传说,今天,人类也面临着“补天”的问题。
试回答:当代所说的“补天”是指什么?你知道采取什么措施可以“补天”?
4.氧气是由氧分子构成的,氧气与其他物质发生化学反应之后,就不再具有原有的化
学性质。在通常情况下,氧气为无色无味的气体,但在一定条件下,氧气可变为淡蓝色液体和淡蓝色雪花壮固体,以上这些知识除说明分子能保质物质的化学性质外,还能得出什么结论?
5.1785年英国科学家卡文迪许通过实验发现,把不含水蒸气、二氧化碳的空气除去氧气(用红热的铜与氧气反应)和氮气以后,人有很少量的残余气体存在,但这个现象没有引起卡文迪许的重视。
100年后,英国物理学家雷利发现:从氮的化合物中制得的氮气密度为1.2505g/L,而从空气中分离出的氮气密度为1.2572g/L。他没有忽视这微小的差异,对其认真研究,因此成就,雷利获得了1904年的诺贝尔物理奖。请回答以下问题:
⑴写出卡文迪许除去氧气的化学方程式 ,此反应类型属于 。
⑵雷利的实验中,两中方法得到的氮气密度有微小差别的主要原因是 。
⑶你认为下列结论中,正确的有------( )
①氩气是一种化学性质极不活波的气体,②雷利从空气中分离出的氮气是纯净物,
③19世纪以前,人们认为空气是有氧气和氮气组成的,
④雷里发现,含氮物质中制得的氮气的密度度小于从空气中分离得到的氮气密度。
A ①②③④ B ③④ C ①③④ D ①②④
⑷对比两位科学家的研究过程,你从中获得的启示是
6.中国科技大学钱逸泰教授等以CCl4和金属钠为原料,在700时制造出纳米级金刚石粉末。该成果发表在世界权威杂志上,立即被科学家们高度评价为“稻草变黄金”同学们对此的一些“理解”不正确的是---( )
A 金刚石属于金属单质, B 制造过程中元素的种类没有变化,
C 这个反应是置换反应, D CCl4是一种化合物
7.“曾青的铁则化为铜”,从现代化学的观点理解,“曾青”应赋予最恰当的含义为 。
A 铜单质 B 硫酸铜溶液 C 铜的化合物 D 可溶性铜盐
8.1999年诺贝尔奖获得者艾哈迈德.潭维尔开创了“飞秒”(10—15秒)化学的新领域,使运用激光光谱技术观察化学反应时分子中原子的运动成为可能。你认为该技术难以观察到的是( )
A 化学反应中反应物分子的分解 B 反应中质子和电子的运动
C 化学反应中生成物分子的形成 D 反应中原子和分子的运动
9.我国1993年研制成功一种由相对原子质量为18、质子数为8的氧原子构成的双原子分子气体。下列说法,正确的是( )
A 这种原子的核外不一定有8个电子
B 该气体的相对分子质量为36
C 若这种原子和氢原子构成水分子,相对分子质量为18
D 这种气体里氧元素的化合价不为零
知识梳理(四)学生归整题萃(06.6.2)
为迎接中考而整理
1.某化合物在空气中充分燃烧后,生成了二氧化碳,则此物质组成中---( )
A 一定有C元素,可能有O元素 B 一定有C元素和O元素
C 只有C元素 D 只有O 元素
2.某物质aɡ完全融于(100—a)ɡ水中所的溶液中溶质的质量分数为--------( )
A 大于a % B 等于a% C 小于a% D 无法确定
3.50ɡ镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发后得到218ɡ固体(已换算为无水硫酸盐),则反应产生的氢气的质量是-------( )
A 2 ɡ B 3ɡ C 3.5 ɡ D 4.5 ɡ
4.向一定的盐酸中加入硝酸银溶液,至恰好反应,过滤后,所得溶液的质量等于所加硝酸银溶液的质量,原盐酸中溶质的质量分数为-----( )
5.下列物质的化学式是根据一种规律排列的:NaCl Cl2 KClO3 HClO4 则
中应填入的下列中的------( )
A MgCl2 B KCl C HClO3 D Ca(ClO)2
6.一定温度下,某物质不饱和溶液的质量分数为a %,饱和溶液的质量分数为b%,溶解度为c,则它们之间的关系是-----( )
A b>a>c B c >b>a C c >b=a D a>b> c
7.对下列实验过程评价,正确的为------( )
A某固体加入稀盐酸,产生了无色气体,证明该固体一定含有CO32-
B某溶液中滴加BaCl2溶液,生成不溶于稀的白色沉淀,则一定含有SO42-
C某无色溶液中滴加酚酞试液显红色,该溶液不一定是碱溶液
D验证烧碱溶液中是否含有Cl-,先加稀硫酸除去OH-,再加AgNO3溶液
8.某工厂原来用氢氧化钠溶液中和所排放废水中的硫酸,现改用氢氧化钾溶液中和以得到钾肥,若氢氧化钾溶液中溶质的质量分数与原来的氢氧化钠溶液中溶质质量分数相同,则此时碱流量阀应------( )
A不变 B 减小流量 C加大流量 D无法确定
9.25g胆矾溶于75g水中完全溶解,所得溶液的溶质质量分数为 。
10.新买的铝锅、铝壶用来烧水时水浸到的地方变黑,说明水中含有-----( )
A钾盐 B钠盐 C 钙盐 D铁盐
11.把锌片放入下列物质中,溶液的质量增加且无气体产生的是------( )
A硝酸银 B稀硫酸 C硫酸镁 D硫酸铜
12.2.7g铝、5.6g铁、6.5g锌和6.4g铜组成的混合物,加入一定量的盐酸,充分反应后还剩下9.2g金属,则生成的氢气为 g。
13.现有C、CO、CuO、盐酸、碳酸钙五种物质,进行单一或两两反应,可以写出生成物中有CO2的方程式为-------( )
A 2个 B3个 C 4 个 D 5个
14.将a个CO分子和b O2个分子通入一密闭容器中,充分反应后容器中碳原子与氧原子的个数比为 。
15.已知,某硫酸溶液中溶质的质量分数为49%,则此溶液中氢元素的质量分数为 。(提示:要考虑溶液中水中的氧元素及溶质中的氧元素)氢离子的质量分数为 。(提示:只有溶质能电离出氢离子,水不能电离)
16.用化学方法鉴别盐酸和火碱时,应选用的试剂是-----( )
A pH试纸 B氢氧化钙 C 硫酸铜 D氢氧化钡
17.鉴别氯化铁、硫酸铜、碳酸钠三种固体,可用多种方法,其中最经济、最简单的方法所用的试剂是 ( )
A水 B 烧碱溶液 C紫色石蕊试液 D稀硫酸
18.在化学实验中,几乎都要用到水,请列举化学实验中水的三种用途 、 、 。(配制溶液)(洗涤仪器)(排水法收集气体)
19.合乎实际,并应用到工业生产中的是-------( )
A 通电分解水 B 高温下用CO把Fe从它的氧化物中还原出来。
C 用工业酒精勾兑白酒 D 高温煅烧石灰石专门制造CO2。
20现榨的苹果汁,在空气中有淡绿色变为棕黄色,你猜测的原因是-------( )
A苹果汁中Fe2+的变成Fe3+ B 苹果汁中含有Cu2+
C苹果汁中含有OH- D苹果汁中含有Na+
21.一定条件下,同一种化学反应进行的快慢与反应物的质量分数成正比。现有100g溶质质量分数为30%的盐酸溶液,与过量的锌反应,为了使反应慢点,而又不应影响生成氢气的质量,可向盐酸中加入( )
A 氢氧化钠 B 冰块 C 氧化镁 D 碘酒的溶剂
22.碳在氧气中燃烧,反应后所得气体中,可能的组成由哪几种情况?请写出每种情况中各气体的化学式: ( CO、CO2 ) ( CO ) ( CO2 ) ( CO2 、O2 )
23.酸、碱、盐两两相互作用,发生复分解反应时,都能得到的一类物质是 (填:酸、碱、盐)
24.已知,NaHS、MgSO4、NaHSO3组成的混合物中,S%=a%,则混合物中O%= 。
25.2.7gAl、5.6gFe、6.5gZn、6.4gCu混合后,加入一定量的稀盐酸,充分反应后,还剩下9.2g金属,则生成的氢气为 。
26.某化合物在空气中充分燃烧后,只有CO2生成,则化合物的组成中-----( )
A只含有C元素 B 只含有O元素
C 含有C元素和O元素 D 一定含有C元素可能含有O元素
27.氯气可用于生产自来水时起消毒作用,氯气跟水反应的方程式为
![]() 则氯气跟石灰水反应不可能生成------( )
则氯气跟石灰水反应不可能生成------( )
A CaCl2 B Ca(ClO)2 C Ca(ClO3) 2 D H2O
28.已知高价铁盐跟铁分在溶液中能发生化合反应,生成亚铁盐。现将一根表面生锈的铁钉浸入到足量的稀盐酸中,最终得到一种浅绿色的溶液,整个过程发生三个化学反应,试用化学方程式简答。
Fe2O3+6HCl==2FeCl3+3H2O
Fe+2HCl==FeCl2+H2↑
![]()
29.用化学方程式解释下列问题:小刚有一枚局部生锈的铜币,为了除去铜币上的锈,他把铜币放在酒精灯上加热,结果绿锈消失,铜币却全部变成黑色。
Cu2(OH)2CO3====2CuO+H2O+CO2↑
![]()
30.化学四种基本反应类型中,一定有化合物生成的的是-------( )
⑴化合 ⑵分解 ⑶置换 ⑷复分解
A⑴⑷ B ⑶⑷ C ⑴⑵ D⑴⑶⑷
31.在反应A + 2 HCl = MgCl2 + B 中,A可能是下列物质中的:
⑴Mg ⑵MgCl2 ⑶Mg(OH)2 ⑷Mg(NO3)2 ⑸MgCO3
A⑴⑶ B ⑴⑵⑶⑸ C ⑴⑵⑶⑷⑸ D ⑵⑶⑸
32.如何证明浓硫酸有吸水性。
33.如何证明CO2和NaOH溶液反应。
34.课本中证明氧气在空气中的成分试验时,能否用蜡烛代替红磷,同时将水换成石灰水。
35.打开浓盐酸瓶口有“白雾”产生,如何证明“白雾”是盐酸的小液滴。
36.如何证明氯酸钾中含有氧元素和氯元素。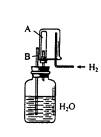
37.已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小。图中容器A是 一种特制的有底的素烧瓷筒,它的壁可以通过氢气分子。实验开始时,A中和烧杯中都充满空气。当向烧杯中持续通入氢气时,导管B处发生的现象是________________,产生这种现象的原因是________________________________。
参考答案:
知识梳理(二)
1B 2D 3D 4A 5C 6A 7B 8C
9、(1)在金属活动性顺序中,排在氢前面的金属。
(2)“盐”或“氧化物”
10、(1)不会发生变化(或会发生变化)
(3)①将一支蜡烛放在集气瓶中,塞上塞子,称其质量为W1g;
②将蜡烛点燃,立即塞上塞子;
③将蜡烛熄灭,集气瓶冷却,在称其质量为W2g;
(4)若W1=W2 ,则蜡烛燃烧前后各物质的质量之和不变。(或:若W1≠W2则蜡烛燃烧前后各物质的质量之和发生变化。
11、
| 实验步骤 | 实验现象 |
| ⑴将气体通过足量的炽热氧化铜粉末 | 固体变为红色 |
| ⑵将步骤⑴余下的气体通过足量的硫酸铜粉末 | 粉末由白色变为蓝色 |
| ⑶将步骤⑵余下的气体通过澄清的石灰水 | 石灰水变浑浊 |
12、
| 实验步骤 | 观察到的主要现象及结论 |
| ⑴加热KClO3,并检查是否有O2放出 | 反应所需温度较高,有O2放出 |
| ⑵加热Fe2O3,并检验是否有O2放出 | 加热后,没有O2放出 |
| ⑶加热KClO3和Fe2O3的混合物 | 与第一步相比,反应所需温度低,但却能迅速放出O2,说明Fe2O3对KClO3的分解反应有催化作用,能加快分解的反应速率 |
13、
| 实验步骤 | 取少量该红色产物放入盛有稀硫酸(或稀盐酸)的试管中,震荡。 |
| 实验现象结论 | 若溶液变为蓝色,说明产物中有Cu2O;若溶液不变色,说明产物中无Cu2O |
| 化学方程式 | Cu2O + H2SO4 == CuSO4 + Cu + H2O |
14、分子在不停地运动,SO2分子和H2S分子由于运动而相互接触并发生反应。
2H2S + SO2 === 3S + 2 H2O
知识梳理(三)
1、解析:物质是由原子、分子等粒子构成的,分子是由原子构成的。在物理变化中,构成物质的原子、分子本身不变。在化学变化中,分子本身发生了变化,反应物的原子重新组合生成新物质,但原子的的种类、数目和质量都不变。所以物质不灭。
2、(1)大胆质疑,尊重实验事实,严谨的治学精神。(2)汞加热生成氧化汞后质量增加。(3)磷和氧气的质量和等于生成五氧化二磷的质量。(4)![]()
或![]() 或
或![]() (6)试管、导管、集气瓶。
(6)试管、导管、集气瓶。
3、臭氧空洞,不用有氟里昂的制冷剂等。
4、分子间有间隔,可以表现出三态变化。
5、(1)![]() 化合反应。(2)卡文迪许制得的氮气中含有了稀有气体等杂质而雷利的实验中制得的氮气是纯净的。(3)A。4、严谨求实的科学态度,不要因为小的差异或疏忽而放过任何一次成功的机会。
化合反应。(2)卡文迪许制得的氮气中含有了稀有气体等杂质而雷利的实验中制得的氮气是纯净的。(3)A。4、严谨求实的科学态度,不要因为小的差异或疏忽而放过任何一次成功的机会。
6A 7D 8B 9B
知识梳理(四)
1B 2D 3C 5D 6B 7C 8C 10D 11D 13C 16C 17A 19B 20A 21B 26C
27C 28 Fe2O3+6HCl==2FeCl3+3H2O Fe+2HCl==FeCl2+H2↑ ![]()
29 Cu2(OH)2CO3====2CuO+H2O+CO2↑![]()
30D 31A