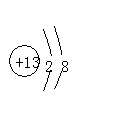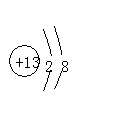![]() 初中化学重点知识提要
初中化学重点知识提要
一、构成物质的基本微粒
1、原子(构成金属、稀有气体)
1定义:化学变化中的最小微粒。(应用于回答化学变化中什么微粒没有改变)
2结构:
![]() 核外电子(带负电)
核外电子(带负电)
![]() 原子
质子(带正电)
原子
质子(带正电)
(不带电) 原子核(带正电)
中子(不带电)—氢原子不含中子
相等关系:原子量≈质子数+中子数
在原子时有:电子数=质子数=核内电荷数=原子序数
3原子性质:质量、体积甚微;不断运动;有间隔
2、分子(构成除稀有气体外的其它气体、有机物、水)
1定义:保持物质的化学性质的一种微粒(应用于回答化学变化中什么微粒改变)
2分子结构:
分子由原子构成。例如:一个水分子由2个氢原子和一个氧原子构成。(应用于分子用什么来描述)
3分子的性质
质量、体积甚微、不断运动、有间隔。(应用于解释日常中的某些现象)
4分子的写法:
某种物质的分子符号就用其化学式表示。
例如:3个二氧化硫分子:3SO2
3、离子(构成酸、碱、盐及其它化合物)
1定义:当原子得、失电子后变成的微粒称离子。
2性质:a、离子是带电的微粒
![]() 即: 阳离子(带正电的原子)
即: 阳离子(带正电的原子)
离子
阴离子(带负电的原子)
b、离子能导电
c、 离子中有:质子数=核电荷数=原子数
质子数≠电子数
4、原子、分子、离子的联系 分子
![]()
![]() 1 原子得失电子
1 原子得失电子 ![]()
![]() 离子
原子 分离
离子
原子 分离
2物质的描述:a、物持由分子构成(水由水分子构成)
b、物质由离子构成(NaCI由Na+和CI—构成)
c、物质由元素组成(MgO由Mg元素和O元素构成)
分子的描述:分子由原子构成。
二、元素——组成物质的宏观单位。
1、定义:具有相同核电荷数(质子数)的一类原子的总称。
2、元素符号:
a、用拉丁字母表示
b、元素含义:1°表示该元素的符号
2°表示一个该原子(P)
3°表示该物质(Fe)
3、地壳中元素质量分数居全四位的是O>Si>AI>Fe
三、初中常见物质化学式及俗称及重要性质和用途
| 物质 | 俗称 | 性质 | 用途 |
| S | 硫磺 | 淡黄色粉末、易燃、于空气中燃烧火焰为淡蓝色、纯氧为蓝紫色,并伴有刺鼻气体产生(SO2) | |
| P | 赤磷 白磷 | 燃烧时产生大量的烟(P2O5固体) | 用物制烟雾弹 |
|
C | 金刚石、石墨、 活性炭 | 金刚石是最硬物质;石墨具有导电性、润滑性、质软;活性炭用于吸附剂 | 金刚石用于制钻头,切割物质。石墨用于电极、润滑、制铅笔 |
| Fe | 化学性质活泼、在潮湿空气中易生锈,于纯氧中燃烧生成Fe3O4) | ||
| P2O5 | 白色固体、易吸水 | 用作干燥剂 | |
| CO2 | 干冰 碳酸气 | 易溶于水、水呈酸性、比空气重 | 人工降雨、工业原料 |
| SO2 | ρSO2>ρ空气、有刺激气味、其水溶液为 H2SO3 | ||
| SO3 | ρSO3>ρ空气其水溶液为H2SO4 | ||
| CH4 | 沼气 坑气 | ρCH4<ρ空气难容于水,无味、易燃、是最简单有机物 | |
| C2H5OH | 酒精 | 易燃烧 | 用于燃料、消毒(70%~75%) |
| CH3OH (甲醇) | 与乙醇相似;有毒(使人眼睛失眠、甚至死亡)易燃烧 | ||
| CH3COOH (乙酸) | 醋酸 水醋酸 | 有刺激气味、具有酸性、能使指示变色 | |
| CaO | 生石灰 | 白色固体、易吸水、溶于水后反应生成熟石灰[Ca(OH)2] | 用于干燥剂 |
| Fe3O4 | 磁铁矿的主要成分 | 黑色物质、难溶于水、可用酸来溶解 | 用于治炼金属铁 |
| Fe2O3 | 磁铁矿的主要成分、铁锈主要成分 | 红褐色难溶物质、可用酸来溶 | 用于治炼生铁 |
| CuO | 黑色难溶于水2Cu+O2=CuO、可被还原剂还原成单质铜、可用酸来溶解 | 用于治炼单质Cu、即Cu+H2=Cu+H2O | |
| CuSO4 | 白色固体、溶于水变成蓝色能与活性比其强的金属反应置换出单质铜来 | 用于检验物质中是否含有水 | |
| CuSO4•5H2O | 胆矾 蓝矾 | 蓝色晶体、溶于水后其性质与CuSO4 溶液一致,易风化即: CuSO4•5H2O=CuSO4+5H2O | |
| KmnO4 | 灰锰氧 | 紫黑色易溶水,其水溶液为红色 | 用于制氧气 |
| KCIO3 | 白色物质易溶于水 | 在MnO2崔化下制氧气 | |
| Cu2(OH)2CO3 | 孔雀石 绿铜 | 绿色难溶于水有毒物,加热变成 CuO、H2O、CO2 | 用在鉴别题中 |
| AgCI | 白色凝乳状物,不溶于酸。可溶性氯化物与AgNO3反应可生成它 | 用于检验Ag+及CI— | |
| BaSO4 | 钡餐 | 白色不溶酸的沉淀,不溶性硫酸盐与不溶性钡盐么应可生成它 | 用于检验Ba+及 SO42— |
| CO | 难溶于水,ρCO>ρ空易燃烧、无味有毒气体 | 用作还原剂、治炼金属 | |
| CaCO3 | 石灰石 大理石 | 白色难溶于水、易溶于酸的固体 | 用于制CO2及制生石灰CaO |
| HCI | 盐酸 | 无色、有刺激气味液体,具有挥发性、腐蚀性。能使指剂变色,能与多种物质反应 | 用于与金属反应制氢气;可用来溶解难溶的物质 |
| H2SO4 | 无色、无味有吸水性、脱水性、腐蚀性的一种酸、能与多种物质反应 | 稀H2SO4可用于与金属反应制氢气;还可用于干燥物质 | |
| HNO3 | 无色、无味的一种酸;具有挥发性,能与多种物质反应 | ||
|
| 火碱 | 白色固体 |
四、主要实验
1、氧气(O2)制法
(一)工业制法:分离液态空气
(二)实验室制法:
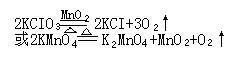 药品:1KCIO3和MnO2(催化剂)或2KMnO4(紫色)
药品:1KCIO3和MnO2(催化剂)或2KMnO4(紫色)
反应原理:
仪器:
 |

步骤:(1)检查气密性(2)装药品 (3)加热 (4)收集 (5)移去水中导气管(6)熄灭酒精灯
实验中常注意问题:(1)酒精灯加热用外焰加热(2)试管夹夹持试管位置于离试管口1/3处(3)试管口略向下斜(4)导气管伸进橡皮塞2—3厘米(5)先移去导管、再移去酒精灯。
2、氢气(H2)制法
(1) 工业制氢气的原料:天然气(主要成分CH4)或水煤气(主要成分CO和H2)
(2) 实验实制氢气:
药品:锌粒(Zn)和稀盐酸或稀硫酸
反应原理:Zn+2HCI==ZnCI2+H2↑
或Zn+H2SO4==ZnSO4+H2↑

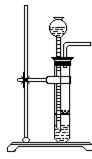 仪器:
仪器:
步骤:略
3、二氧化碳(CO2)制法:
药品:石灰石(大理石)和稀硫酸
反应原理:CaCO3+2HCI==CaCI2+CO2↑+H2O
仪器:其仪器与氢气的仪器大致相同、不同为在CO2收集中不用排水法收集。(所以CO2的制取装置可用来制取H2)
 步骤:略
步骤:略
4、氢气还原氧化铜实验:
药品:H2和黑色CuO
△
![]() 反应原理:H2+CuO===Cu+H2O
反应原理:H2+CuO===Cu+H2O
仪器:
![]()
步骤:(1)先通H2一段时间(以防止通入
的H2与试管内空气混合遇火发生爆炸
(2)加热 (3)移去酒精灯 (4)再通氢气一段时间(以防止还原出的Cu在高温下又被氧化为CuO)
注意:(1)实验中的“两通”的目的
(2)导气管位置:不用橡皮塞;试管口略向下倾斜
(3)看到实验现象:A、试管壁有水珠生成B、黑色物质变成红色物质
5、Cu(OH)2CO3的加热实验:
A、反应原理:Cu(OH)2CO3==2CuO+H2O+CO2↑
![]()
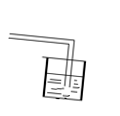
 B、仪器: Cu(OH)2CO3
B、仪器: Cu(OH)2CO3
![]() 石灰水
石灰水
C、实验现象:绿色物质变成黑色物质:在试管壁上有水珠生成;将产生气体通入澄清石水,石灰水变浑浊。
6、电解水实验:
所需物质及仪器:水、直流电、电解仪器
电解
反应原理:2H2O==2H2↑+2O2↑
现象:在阳极和阴极分别有气体产生且有V阳:V阴=2:1
(即VH2:VO2=2:1)
注意:电解水产生氢气和氧气得出结论是:(略)
五、重要反应:
(一)四个反应类型:
化合反应:多各物质经化学变化合为一种物质的反应
![]() 分解反应:由一种物质分妥成多种物质的化学反应
分解反应:由一种物质分妥成多种物质的化学反应
![]() 即:BAC条件 B+A+C
即:BAC条件 B+A+C
![]() 置换反应:单质与化合物发生化学变化生成新的单质与新的化合物的反应:即:单+化合物 条件 新单+新化合物
置换反应:单质与化合物发生化学变化生成新的单质与新的化合物的反应:即:单+化合物 条件 新单+新化合物
![]() 分解反应:化合物A+化合物B 化合物C+化合物D
分解反应:化合物A+化合物B 化合物C+化合物D
(二)主要反应方程式:
![]() S+O2===SO2 (气)
Fe2O3+3CO====2Fe+3CO2
S+O2===SO2 (气)
Fe2O3+3CO====2Fe+3CO2
![]()
![]()
![]()
4P+5O2======2P2O5(固) Fe 3O4+4CO=====3 Fe+4CO2
![]()
![]()
![]()
![]()
3 Fe+2O2===== Fe3O4(固) 2KCIO3====2KCI+3O2↑
![]()
![]()
![]()
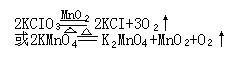 Mg+O2=====2MgO(固) 2KMnO4=====K2MnO4+MnO2+O2↑
Mg+O2=====2MgO(固) 2KMnO4=====K2MnO4+MnO2+O2↑
C+O2====CO2 Zn+2HCI====ZnCI2+H2↑
![]() Zn+H2SO4===ZnSO4+H2↑
Zn+H2SO4===ZnSO4+H2↑
2C+O2====2CO Fe+2HCI===FeCI2+H2↑
![]()
![]()
2CO+O2=====2CO Fe+H2SO4====FeSO4+H2↑
![]()
![]()
CO2+C====2CO Cu+O2====2CuO
![]()
CO2+Ca(OH)2====CaCO3↓+H2O CuO+H2===Cu+H2O
CO2+H2O====H2CO3 CuO+CO====Cu+CO2
CO2+2NaOH===Na2CO3+H2O CuO+2HCI====CuCI2+H2O
![]()
CaCO3====CaO+CO2↑ Cu(OH)2+HCI===CuCI2+H2O
CaCO3+2HCI===CaCI2+H2O+CO2↑ CuSO4+2NaOH===Cu(OH)2+Na2SO4
CaO+H2O====Ca(OH)2 Na2CO3+CaCO3↓+2NaOH
![]()
![]()
CH4+2O2====CO2+2H2O C2H5OH+3O2====2CO2+3H2O
![]()
CH3OH+ O2====CO2+2H2O
(三)主要反应类型
(1)碳酸盐与酸的反应:反应都生成CO2
即:MSO4+2HCI====MCI2+CO2↑+H2O
(2)硫酸盐与钡盐的反应:反应后都生成难溶于酸的BaSO4↓
即:MSO4+BaN====BaSO4↓+MN
(3)盐酸盐与AgNO3反应:生成难溶酸的AgCI↓
即:盐酸盐+AgNO3====AgCI↓+酸
(4)金属氧化物一般难溶水(除K2O、Na2O、CaO)外易溶于酸
(5)非金属氧化物一般易溶碱溶液中
![]() (6)酸+碱 盐+水 (中和反应)
(6)酸+碱 盐+水 (中和反应)
六、化学中几个重要概念:(对照课本熟记概念)
(1)化学变化(2)物理变化(3)稀有气体(4)氧化反应(5)催化剂(6)燃烧(7)混合物(8)化合物(9)纯净物(10)单质(11)氧化物(12)酸性氧化物(13)碱性氧化物(14)酸(15)碱(16)盐(17)结晶水合物(18)原子量(19)风化(20)质量守恒定理(21)饱和溶液(22)溶解度(23)有机化合物(24)温室效应(25)工业血液、工业粮食(26)生铁、钢(27)合金(28)溶液、溶质、溶剂(29)过滤、结晶(30)PH值
七、几个物质及离子鉴别
(一)常见气体鉴别方法
![]()
![]() O2
燃烧更旺:O2
O2
燃烧更旺:O2
![]()
![]() H2
木条熄灭:CO2 分别往集 变红:CO2
H2
木条熄灭:CO2 分别往集 变红:CO2
![]() CO2
NH3 气瓶中滴少
变蓝:NH3
CO2
NH3 气瓶中滴少
变蓝:NH3
CO 燃着木条分别 N2 许石蕊试液 不变:N2
![]()
![]()
![]() CH4 伸到各集气瓶内
H2O
CH4 伸到各集气瓶内
H2O
![]()
![]()
![]() NH3
有水珠:
NH3
有水珠:
![]() N2
被点燃气体:H2 于火焰上方
CH4
N2
被点燃气体:H2 于火焰上方
CH4
![]() CO 罩干冷烧杯
CO 罩干冷烧杯
![]() CH4
无水珠:CO
CH4
无水珠:CO
![]()
![]() 产生气体 变浑:CH4
产生气体 变浑:CH4
![]() 通入石灰水中
不变浑:H2
通入石灰水中
不变浑:H2
(二)酸、碱、盐鉴别
(1)酸、碱、盐用紫色石蕊鉴别
(2)盐酸盐(可溶性)鉴别
试剂:AgNO3和稀HNO3
![]() 步骤:(1)取少量待测液于试管中(2)滴入几滴稀HNO3(3)有白色沉淀产生,该沉淀不能溶于稀HNO3中说明是盐酸盐即含有CI—
步骤:(1)取少量待测液于试管中(2)滴入几滴稀HNO3(3)有白色沉淀产生,该沉淀不能溶于稀HNO3中说明是盐酸盐即含有CI—
(3)硫酸盐鉴别:
试剂:BaCI2和稀HNO3
步骤:(1)取少量待测液于试管中(2)滴入BaCI2并加稀HNO3,若产生沉淀则说明是硫酸盐即含SO42—
(4)可溶性钡盐鉴别:(略)
(5)碳酸盐鉴别:(略)
(6)铵盐(NH4+)鉴别:(略)
八、常见计算:
(一)相对分子质量的计算:
(1)求(NH4)2SO4和Na2CO3•10H2O的分子质量。
(NH4)2SO4=(14+4)×2+96
=132
Na2CO3•10H2O=23×2+12+16×3+10×(2+16)
=106+180
=286
(二)、化合物中某一元素的质量分数
求Ca(OH)2中 钙元素的质量分数
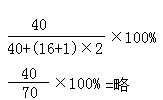
Ca%=
=
(三)化合物中某一元素的真实质量
求80克水中氢元素有几克?
![]() 解:80×
解:80×
(四)组成物质中的元素质量之比:
求:Na2CO3中C: Na:O为多少?
解:∵C=12,Na=2×23=460=16×3=48
∴C: Na:O=12:46:48=6:23:24
(五)求化合物中各原子个数之比
求C11H24O6中的各原子个数之比
解:C:H:O=11:24:6
(六)含杂质物质的计算题
方法:先把含杂质的物质的质量转变成纯净物质质量,然后再代入方程式中
典型例题:
200吨的赤铁矿石其中含杂质6%,求可冶炼出含杂质3%的生铁多少吨?
![]() 解:分析:赤铁矿石主要成分是Fe2O3,其质量是200×94%=188t,设有xt生铁治炼出来,则纯铁质量是x×97%,所以据:
解:分析:赤铁矿石主要成分是Fe2O3,其质量是200×94%=188t,设有xt生铁治炼出来,则纯铁质量是x×97%,所以据:
Fe2O3+3CO==3CO2+2Fe
160 112
![]() 188
97%X
188
97%X
∴X=……(略)
(七)氢气还原氧化铜题型
足量的氢气通过灼热的氧化铜,待完全反应后,将产生的物质通入放有无水硫酸铜的U型管中,发现U型管中物质质量比原来质量增重5.4克,求有多少克的氧化铜参加反应?
![]()
![]() 解:设有X克的CuO参加反应
解:设有X克的CuO参加反应
CuO+H2===Cu+H2O
80 18
X=2.4 5.4 答:略
(八)氯酸钾加热制氧气题型
方法:根据题意,计算出氧气质量。用原固体混合物质量—后来固体混合物质量=产生的氧气质量
例:把混有少量KMnO4的KCIO320克充分加热后,待完全反应称量反应固体物质为6克,将固体剩余物用水充分溶解,过滤称得滤渣为2.25克。求总的有多少氧气产生,原混合物中KMnO4的质量分数是?
解:产生的氧气质量=20—6=14克
由题意知产生的14克氧气是由KMnO4和KCIO3同时反应产生的故不能由14克氧气求KMnO4 (KCIO3)。由题意知滤渣2.55克即为产生的MnO2的质量:
2KMnO4====K2MnO4+MnO2+O2↑
316 87
X=a 2.25
![]() 故KMnO4%=
故KMnO4%=
答:略
(九)溶液质量分数题型
方法:(1)溶液质量分数的林计算题一般涉足了发生化学变化,故应写出化学方程式,然后把所给己知数(通常给溶液质量)转变成溶质质量后带到方程式中(2)求产生的溶液的质量分数时,要搞清楚改变后的溶质量=反应前溶液质量+溶解的固体物质(或者加入了的液体物质质量)—沉淀质量(气体质量)
例:60克Na2CO3溶液与20%的AgNO3溶液完全反应后过滤称得固体质量为2.76克,求(1)Na2CO3溶液的质量分数(2)有多少克AgNO3溶液参加反应(3)产生溶液中溶质质量分数?
解:Na2CO3+2 AgNO3====Ag2CO3+2 NaNO3
106 240 276 170
X=1.06 y=3.4 2.76 Z=1.7
![]()
![]() ∴(1)Na2CO3溶液质量分数:
∴(1)Na2CO3溶液质量分数:
(2)参加反应的AgNO3溶液质量:
![]() (3)形成的溶液中Na2CO3的质量分数为:
(3)形成的溶液中Na2CO3的质量分数为:
Na2CO3%= =C
答:略
九、几种符号写法
(1)离子的写法
方法:先写出元素符号,再在右上角标明该离子带的电荷数,注意“+、—”于数字后面
例:3个硫酸根离子:3SO42—;两个镁离子:2Mg2+
(2)分子的写法
方法:写某物质的一个分子符号时,就用该物质的化学式表示其分子符号。
例:3个二氧化硫分子:3SO2;一个氨气分子:NH3
(3)结构示意图
原子结构示意图:先确定圆圈内数值(即为原子系数)然后再依次排出其电子数来。原子时有:电子决数==圆圈内的质子数。
例:画出钠原子的结构示意图
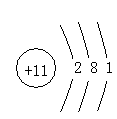 |
![]() 离子结构示意图:先确定圆圈内的数值(仍为原子序数)然后再排电子数时,电子数总和等于质子数加上或减去所带的电荷数。
离子结构示意图:先确定圆圈内的数值(仍为原子序数)然后再排电子数时,电子数总和等于质子数加上或减去所带的电荷数。
例:画出AI3+的结构示意图