初中化学总复习-化学计算2
应试能力测试:
一、选择题(每小题只有一个选项符合题意。)
1.有一种氮的氧化物,氮和氧的质量比为7∶4,则此氮的氧化物化学式为 ( )
A. N2O B. NO2 C. N2O3 D. N2O5
2.已知(NH4)2SO4和(NH4)2HPO4的混合物中含氮元素为21.2%,则混合物中含氧约为( )
A. 42.2% B. 48.5% C. 81% D. 无法确定
3.已知某硫酸钠溶液中Na+ 与水分子个数比为1∶100,则该溶液中溶质的质量分数为
( )
A. 3.8% B. 7.8% C. 2.0% D. 4.2%
4.由Na2CO3和CaCO3组成的混合物,经测定其中碳元素的质量分数为11.64%,则下列各项中:① 钠元素的质量分数,② 钙元素的质量分数,③ 氧元素的质量分数,④ CaCO3的质量分数,⑤ CaCO3的质量分数,⑥ Na2CO3和CaCO3的质量比,其中能确定的是( )
A. 都不能确定 B. 只有③能确定
C. 只有④⑤⑥能确定 D. 都能确定
5.将a g胆矾溶解在b g水中,所得溶液中溶质的质量分数是 ( )
A. ![]() ×100%
B.
×100%
B. ![]() ×100%
×100%
C.
![]() ×100%
D.
×100%
D. ![]() ×100%
×100%
6.某铁的氧化物5.8 g,加热时用氢气充分还原,剩余固体质量为4.2 g,则此铁的氧化物的化学式为 ( )
A. FeO B. Fe2O3 C. Fe3O4 D. 无法确定
7.有a g质量分数为15%的硝酸钠溶液,若想将其溶质的质量分数变为30%,可采用的方法是 ( )
A. 蒸发掉溶剂的![]() B. 蒸发掉
B. 蒸发掉![]() a g溶剂
a g溶剂
C. 加入![]() a g硝酸钠
D. 加入同质量的15%的硝酸钠溶液
a g硝酸钠
D. 加入同质量的15%的硝酸钠溶液
8.有反应A+3B=2C+3D,已知A、B、C、D四种物质的相对分子质量为M1、M2、M3、M4,恰好完全反应时,A、B、C、D的质量分别为m1、m2、m3、m4,现给出下列六个关系时,肯定成立的关系式为 ( )
① m1∶m2=m3∶m4,② m1+m2=m3+m4,③ M1∶M2=M3∶M4,④ M1+3M2=2M3+3M4,⑤ m1∶m2=M1∶M2,⑥ m1∶m2=M1∶3M2。
A. ②④⑥ B. ①③ C. ④⑥ D. ①③④⑤
9.在天平两边的托盘上各放上一个盛有36.5 g质量分数为20%的盐酸的烧杯,此时天平是平衡的。现将一定质量的两种物质分别加入烧杯中,两烧杯中的反应都恰好完全反应,此时天平仍保持平衡,则加入的物质可能是 ( )
A. Mg和MgO… B. MgO和Mg(OH)2
C. Mg和MgCO3 D. MgO和MgCO3
10.某一温度下,将质量均为m g的氢氧化钠和氢氧化钾分别全部溶解在质量为n g的水中。下列说法正确的是 ( )
A. 若该温度下两物贡的溶解度相等,则它们的溶解度一定是![]() g
g
B. 所得两种溶液中溶质的质量分数相等,其数值为![]() %
%
C. 在两种溶质里氧元素的质量分数相等,其数值为![]() %
%
D. 在两种溶质里氢、氧两元素的质量比相等,均为l∶7
11.使25 g甲物质与5 g乙物质充分反应,所得混合物中含有10 g甲和11 g丙,还有一种新物质丁,若甲、乙、丙、丁的相对分子质量分别为30、20、44、18,其化学式分别用A、B、C、D表示,则下列化学方程式正确的是 ( )
A. A+B=C+D B. A+2B=2C+D
C. 2A+B=2C+D D. 2A+B=C+2D
二、填空题
12.已知氮元素在一定条件下生成的一种氧化物,其氮元素与氧元素的质量比为7∶20,则该氧化物的化学式为 。
13.在稀硫酸和硫酸铜的混合溶液中,加入适量铁粉,使其正好完全反应,反应后经过滤得到固体物质与所加铁粉的质量相等。则混合溶液中硫酸和硫酸铜的质量比为 。
14.i℃时,把a
g NaCl固体投入到b g水中( i℃时,NaCl的溶解度为c g),该NaCl溶液中,当NaCl的质量分数既可以用![]() ×100%计算,也可以用
×100%计算,也可以用![]() 计算,则该NaCl溶液是
溶液。(填“饱和”或“不饱和”)
计算,则该NaCl溶液是
溶液。(填“饱和”或“不饱和”)
15.某Na2S、Na2SO3、Na2SO4的混合物中,S的质量分数为32%,则此混合物中Na与S的质量比为 ,O质量分数为 。
三、计算题
16.某元素有可变化合价,该元素在价态为a的氧化物中的质量分数为50%,在价态为a+2的氧化物中的质量分数为40%,求该元素的相对原子质量。
17.一块表面被氧化成三价金属氧化物的金属样品A,据测定该氧化物中金属元素与氧元素的质量比为9∶8。取样品A 12.9 g放入300 g稀盐酸中,待样品A完全溶解后,收集到0.3 g氢气;在反应后的溶液中,加入10%的氢氧化钠溶液40 g,恰好将溶液中剩余的盐酸中和。求:
(1) 该金属的相对分子质量;
(2) 样品A中此金属元素的质量分数;
(3) 所用盐酸中溶质的质量分数。
四、创新题
18. 将8 g硫粉分别在一定量的氧气中充分燃烧,实验如下:
| 第一次 | 第二次 | 第三次 | |
| 氧气的质量/ g | 5 | 8 | 16 |
| 生成SO2的质量 / g | 10 | 16 | 16 |
(1) 这三次实验中,哪次符合质量守恒定律?为什么?
(2) 第一次为什么是生成10 g二氧化硫,而不是13 g二氧化硫?哪种物质有剩余?
(3) 第三次为什么是生成16 g二氧化硫,而不是24 g二氧化硫?哪种物质有剩余?
(4) 求二氧化硫中硫元素和氧元素的质量比。
答:(1) 表面看只有第二次符合质量守恒定律,实际上都符合。因为第一次是硫有剩余,第三次是氧有剩余。而质量守恒定律是指参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和,所以三次实验都符合。
(2) 第一次是因为有一部分硫没有参加反应,剩余物质是硫,为3 g。
(3) 第三次是因为有一部分氧气没有参加反应,剩余物质是氧气,为8 g。
(4) 由第二次可知,16 g二氧化硫中含有8 g硫元素和8 g氧元素,所以硫元素与氧元素的质量比为1∶1。
链接中考:
一、选择题(每小题只有一个选项符合题意。)
1.(02南京)“神舟三号”宇宙飞船飞行成功,表明我国载人航天技术有了重大突破。运送“神舟三号”飞船的火箭所使用的燃料是偏二甲肼(化学式为C2H8N2)。下列说法正确的是(相对原子质量:H—1;C—12;N—14) ( )
A.偏二甲肼是由碳、氢、氮三种元素组成的
B.偏二甲肼中含有氮气
C.偏二甲肼的相对分子质量是27
D.偏二甲肼中碳、氢、氮三种元素的质量比为1:4:1
2.(02黑龙江)在天平两端各放一个盛有200g 18.25%盐酸的小烧杯,调节天平平衡。分别向两烧杯中加入下列各组物质充分反应后天平仍保持平衡的是 ( )
A.18 g Mg、18 g Al B.20 g CaO、20 g CaCO3
C.10 g AgNO3、5 g Cu(OH)2 D.4 g Mg (OH)2、8.4 g MgCO3
3.(02山东)在化学反应A + 2B=C + 3 D中,2g A与4.1g B完全反应,生成5.6 g C。当有1.5g D生成时,参加反应的A的质量是( )
A.6g B.5.6g C.4.5g D.0.5g
4. (02山西)下列四个图象分别表示对应的四种操作过程,其中正确的是 ( )
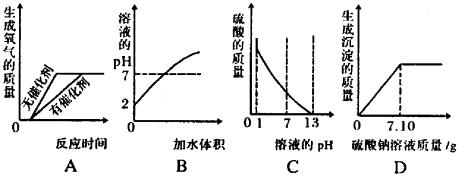
A.加热氯酸钾制取氧气
B.向pH =2的盐酸中不断加水稀释
C.向pH =1的硫酸溶液中逐滴加入pH =13的KOH溶液
D.向10.4g 10%的BaCl2溶液中逐滴加入10%的Na2SO4溶液
5.(02扬州)把400g 20%的氯化钠溶液稀释成10%的溶液需加水 ( )
A.100g B.200g C.400g D.800g
二、填空题
6.(02甘肃)2001年诺贝尔化学奖授予了美国化学家诺尔斯博士与日本化学家野依良治教授和美国化学家沙普利斯教授,以表彰他们对催化不对称合成的重大贡献。环氧化(R) ——丙烯醇(化学式为C3H6O2),是沙普利斯应用不对称合成技术合成的一种重要物质。该物质用于生产一种治疗心脏病 的药物。计算(计算结果保留一位小数):
(1)该物质中碳、氢、氧三种元素的质量比为 ;
(2)该物质中氧元素的质量分数为 。
7.(02福州)称取氯化钠和氯化钙的固体混合物14g,放入烧杯中,加入96g碳酸钠溶液恰好完全反应(反应的化学方程式为:Na2CO3 + CaCl2 = CaCO3↓+ 2 NaCl)。待反应完全后过滤,称得滤液的总质量为100g。
(1)根据质量守恒定律,可知生成的沉淀质量为 。
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
答 案
应试能力测试:
一、1. A 2. B 3. A 4. D 5. D 6. C 7. B 8. A 9. D 10. B 11. D
二、12. N2O5
13. 7∶80
14. 饱和
15. 23∶16;22%
三、 16. 解:设元素为R,则化学式为R2Oa和R2Oa+2,由题意可得:
![]()
![]() ×100%=50%
×100%=50%
![]() ×100%=40%
×100%=40%
解得:R=32
答:该元素的相对原子质量为32。
17. 解:(1) 设氧化物的化学式为R2O3,R的相对原子质量为x,
2x∶16×3=9∶8, x=27,知是铝(Al)元素。
(2) 设生成0.3 g氢气时,反应的Al和HCl的质量分别为y和z,
2Al+6HCl=2AlCl3+3H2↑
54 219 6
y z 0.3 g
54∶y=6∶0.3 g,y=2.7 g
219∶z=6∶0.3 g,z=10.95 g
Al2O3的质量为:12.9 g-2.7 g=10.2 g
设Al2O3与反应的HCl的质量分别为w,
Al2O3+6HCl=2AlCl3+3H2O
102 219
10.2 g w
102∶10.2 g=219∶w,w=21.9 g
w(Al)=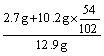 ×100%=62.8%
×100%=62.8%
(3) NaOH的质量为:40 g×10%=4 g
设与NaOH溶液反应的HCl的质量分别为p,
NaOH+HCl=NaCl+H2O
40 36.5
4 g p
40∶4 g=36.5∶p,p=3.65 g
w(HCl)=![]() ×100%=12.2%
×100%=12.2%
答:(1) 该元素的相对原子质量为27,(2) 样品中铝的质量分数为62.8%,(3) 盐酸中溶质的质量分数为12.2%。
链接中考:
一、1.A 2.D 3.A 4.D 5.C
二、6.(1)18:3:16 (2)43.2%
7.(1) 10 g
(2) 设固体混合物中含氧化钙的质量为x,反应后生成氯化钠的质量为y,
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100 2×58.5
x 10 g y
x=![]() =11.1 g
=11.1 g
y=![]() =11.7 g
=11.7 g
原混合物中氯化钠的质量=14 g-11.1 g=2.9 g
(3) 所得滤液的溶质的质量分数=![]() ×100%=14.6%
×100%=14.6%
答:(略)。