第九单元 溶 液
一、选择题(每小题2分,共40分)
1.下列有关实验操作的叙述,正确的是( )
A. 蒸发食盐溶液时,待水完全蒸干后再停止加热
B. 稀释浓硫酸时,将水倒人盛浓硫酸的烧杯里
C. 取用试剂时,将用剩的药品放回原试剂瓶里
D. 过滤时玻璃律的一端要接触三层滤纸处
2.粗食盐的杂质主要是MgCl2,工业上常把粗盐晶体粉碎后用饱和食盐水浸洗,再滤出食盐。对此,下列有关说法中正确的是( )
A. 浸洗前后,被浸洗的食盐中MgCl2的含量不变
B. 浸洗前后,食盐水中NaCl的质量不变
C. 浸洗用的饱和食盐水可以无限次的使用下去
D. 粗盐粉碎的颗粒大小影响浸洗后盐中MgCl2的含量
3.下图所示的四项基本操作中,正确的是( )
4.提纯含有少量泥沙的粗盐,下列操作顺序正确的是( )
A. 过滤、蒸发、结晶、溶解 B. 溶解、蒸发、过滤、结晶
C. 溶解、蒸发、结晶、过滤 D. 溶解、过滤、蒸发、结晶
5.把少量下列物质分别放到水中,充分搅拌后可以得到溶液的是( )
A. 植物油 B. 面粉 C. 硝酸银 D. 蔗糖
6.下列关于溶液的说法正确的是( )
A.从一杯质量分数为10%的食盐溶液中倒出一半,余下的溶液质量分数为5%
B.某饱和溶液降温后析出晶体。此时它就变成不饱和溶液
C.向某物质的饱和溶液中加少量该物质.恒温下放置一定时间后,溶液中溶质的质量分数变大
D.稀溶液可能是饱和溶液,浓溶液也可能是不饱和溶液
7.把烧杯中80℃时硝酸钾饱和盛液冷却至室温,下列说法错误的是( )
A.烧杯中溶剂的质量不变 B.烧杯中溶液的质量减少
C.烧杯中硝酸钾的质量不变 D. 烧坏中溶液的质量不变
8.在一定温度下,通过蒸发溶剂,使某溶液中有晶体析出,则下列叙述正确的是( )
A.留下的溶液可能是饱和溶液,也可能是不饱和溶液
B.留下的溶液中溶质质量分数一定不小于原溶液中溶质的质量分数
C.再降低温度,一定有晶体析出
D.留下的溶液不能再溶解其他物质
9.浓溶液用稀释过程中,保持不变的是( )
A. 溶质的质量 B. 溶剂的质量 C. 溶液的质量 D. 溶液的浓度
10.现有100克溶质质量分数为10%的某溶液,使其浓度增大一倍可采用的方法是( )
A.溶剂的质量蒸发掉一半
B.溶质的质量增加一倍
C.蒸发掉的溶剂质量等于溶液质量的一半
D.加入200克溶质质量分数为25%的此溶液
11.现有50℃硝酸钾饱和溶液,欲使其成为不饱和溶液,可采用的方法有①降低温度②升高温度③增加溶质④减少溶剂⑤增加溶剂 ( )
A.①③ B.②④⑤ C.①③④ D.②⑤
12.配制10%的食盐溶液,需要用到的玻璃仪器有( )
A天平、烧杯、玻离棒 B、量筒、烧杯、玻璃棒
C.药匙、玻璃棒、烧杯 D.天平、烧杯、玻璃棒、量筒
13.在粗盐提纯中,滤液倒入蒸发皿中用酒精灯加热,当蒸发皿里出现( )情况时,停止加热
A. 水分全部蒸干 B. 出现大量固体 C. 液体开始沸腾 D. 出现少量固体
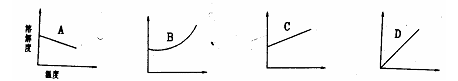 |
14.下面是四种固体物质的溶解度曲线,这些物质分别为A、B、C、D,根据曲线判断其中能用降温结晶方法进行提纯的物质是。,能用蒸发方法提纯的物质是( )
15.现有30%的盐酸20克,因实验需要把它配成10%的盐酸,应选用的一组仪器是( )
A.托盘天平、烧杯、玻璃棒 B.托盘天平、量筒、玻璃棒
C.量筒、烧杯、托盘天平 D.量筒、烧杯、玻璃棒
16.要将KNO3、NaCl、MnO2三种物质组成的混合物—一分离,加水溶解后,其正确的分离方法是( )
A.先结晶后过滤 B.先过滤后结晶C.只需过滤 D.先蒸发后过滤
17.在托盘天平两边放等质量的烧杯,内均盛有等体积、等溶质量分数的盐酸。若在左右两烧杯里分别加入少许等质量锌与石灰石,反应后天平指针偏转情况是( )
A.左转 B.右转 C.仍平衡 D.无法判断
18.t℃时,欲使一接近饱和的溶液变成他和溶液,分别采取下列措施:①降低温度,②升高温度,③加水,④加入足量溶质。其中一定能达到目的的是( )
A.只有① B. 只有④ C. ①③ D. ②④
19.下列操作中:①取用药品,②溶解,③过滤,④蒸发。其中要使用到玻璃棒的是( )
A. ① B. ①② C. ①②③④ D. ②③④
20.将氯化钠和硝酸钾的混合物用结晶法分离,对于滤液(母液)来说,下列说法能够成立的是( )
A.滤液中不含硝酸钾 B.滤液中不含氯化钠
C.滤液是硝酸钾不饱和溶液 D.滤液是硝酸钾饱和溶液
二、填空题(每空1分,共33分)
1.将A.食盐B.葡萄糖C.粉笔灰D.汽油E.氯化氢F.木炭粉放入水中,充分振荡后,能形成溶液的是(填编号) 。
2.欲从草木灰中除去不溶性的固体杂质来提取固体碳酸钾
①此实验操作顺序如下:a称量样品;b溶解、沉淀;c ;d ;冷却结晶
②在进行C步操作时,有时可能重复进行,这是由于 。
③在进行d步操作时,要用玻璃棒不断地小心搅拌液体,目的是防止 。
3.把硫酸锌溶液放在一敞容器内、当水分慢慢蒸发后,溶液首先会达到 ,继续蒸发就会析出 。
4.过滤液体时,倒入过滤器内液体的液面应比滤纸边缘 ;用量筒量取液体时,量简必须放平,视线要跟量筒内液体 保持水平,再读出体积数;用蒸发皿蒸发滤液时,要用玻璃棒地搅拌,其目的是 .
5.过滤法分离两种固体的混合物,该两种物质在溶解性方面,一种应 ,另一种应 ;用结晶法分离两种固体的混合物,该两种物质的溶解度一种 ,另一种应 。
6.现有研细的NaCl和KNO3固体混合物,欲分离得到两种比较纯净的固体。清指出分离操作的主要步骤,按先后次序写出分离操作中所用到的四种主要仪器的名称是 , , , 。
7.欲除去下列物质中的杂质,把适用的试剂、操作方法的序号写在相应的横线上。
①加适量盐酸、过滤、蒸发。②加适量水、过滤、蒸发。③加适量水、过滤。④加热(或高温灼烧)。⑤加适量盐酸、蒸发。⑥加热、加适量水、过滤。⑦加适量水、再蒸发。
(1)碳酸钙中含有少量Na2CO3 。
(2)KCl粉末中含有少量K2CO3 。
(3)CaO中含少量CaCO3 。
(4) MnO2中含有少量炭粉 。
(5) KCl中含有少量KCIO3 。
8.溶液最基本的特征有两个,一是它的 性,具体指的是 ;二是它的 性,具体指的是 。
9.现有一瓶接近饱和的硝酸钾溶液,要使此溶液成为饱和溶液,可以 或 。
10.现有温度相同的某物质的饱和溶液两份,其中一份的质量是另一份的4倍,分别将它们恒温蒸去259水,析出晶体的质量比是 。
11.用量筒量取100毫升水,然后将氢氧化钠加入量筒中的水里,边加边搅拌,指出配制中的两种错误及其后果。
错误:A ,后果 ;
错误:B ,后果: 。
三、简答题(共8分)
1.为什么衣服沾上少量的油渍可以用汽油去除?
2.有锌粉和铜粉的混合物。
①能否用过滤或结晶的方法把它们分离开?为什么?
②设计一个将锌粉除去而剩余铜粉的方案。
3.在30℃时,某试管中盛有一定量的硝酸钾溶液,怎样用实验方法证明它是饱和溶液还是不饱和溶液?
四、实验题(共11分)
按下列实验步骤和要求回答粗盐提纯的有关问题。
第一步:溶解。
在天平上称取5.0g粗盐,计算在10mL水中溶解的粗盐的质量(已知5.0g粗盐在10mL水中不能完全溶解)。
①称量:称量前先把 ,检查天平的摆动是否平衡,当发现指针偏左时,紧接着的操作是 ,准确称取5.0g粗盐。
②溶解:量取10mL水倒人烧杯里,用药匙加粗盐于水中,用玻璃棒搅拌,直到粗盐不再溶解时为止。要估算粗盐在10mL水中溶解的质量,还应进行的实验是 。
第二步:过滤。
①待过滤的混合液在引流之前往往静量一会儿,其目的是 。
②引流时与玻璃棒下端接触的部分是 。
③若滤液仍然浑浊,应 。
第三步:蒸发。
①如果蒸发血中有液滴飞溅,原因是 。应采取的措施是 。
②当蒸发皿出现多量固体对,应 。
第四步:转移。
用 将固体转移到纸上, 后,回收到指定容器中。
五、计算题(共8分)
1.现有溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)50mL,如要制成质量分数为25%的稀硫酸,求需要水多少mL?
2.用120g稀硫酸跟一定质量的锌恰好完全反应,生成了0.4g氢气,计算:
(1)稀硫酸中硫酸的质量分数;
(2)反应后所得溶液中溶质的质量分数。
一、选择题
1. D 2.D 3.B 4.D 5.D 6.D 7.D 8.B 9.A 10.C 11.D 12.D 13.B 14.D 15.D 16.B 17.A 18.B 19.D 20.D
二、填空题
1.ABE
2.(1)过滤;蒸发;(2)滤液中混有不溶性杂质;(3)液体局部过热而飞溅。
3.饱和,硫酸锌晶体。
4.低,凹液面最低处,防止液体局部过热而飞溅。
5.不溶,可溶;随温度变化大,随温度变化小。
6.烧杯,铁架台(带铁圈),蒸发皿,漏斗。
7.(1)③;(2)⑤;(3)④;(4)④;(5)④。
8.均一,溶液中各部分组成和性质相同;稳定,外界条件不变时,溶液中的溶质不会析出。
9.降温,加溶质,蒸发溶剂。
10.1:1
11.错误A:用量筒配制溶液,腐蚀量筒;错误B:用玻璃棒在量筒中搅拌,打破量筒。
三、简答题
1.因为油渍可溶于汽油。
2.(1)不能,因为它们都不溶于水;(2)加入过量稀硫酸,充分反应后过滤、洗涤、晾干。
3.向试管中加入硝酸钾晶体,如晶体能溶则为不饱和溶液,反之为饱和溶液。
四、实验题
第一步
1.游码归零,将平衡螺母向右调节。
2.过滤并称量剩余固体的质量。
第二步
1.将悬浮的固体杂质沉淀下来,。
2.滤纸的三层面。
3.重复过滤,直到澄清。
第三步
1.蒸发皿中液体局部过热,用玻璃棒搅拌。
2.停止加热,用余温蒸干。
第四步
玻璃棒,晾干
五、计算题
1.268.64g
2.(1)16.3%;(2)24.3%