课时3 定量认识化学变化(1)
自学导航
1.物质在发生化学变化时,一定有( )
A.新物质生成 B.能量变化
C.颜色变化 D.生成气体或沉淀
2.火柴燃烧是 变化,反应后灰烬的质量比反应前 ;酒精灯里的酒精燃烧后 (有、无)灰烬,属 _ 变化。
3.铁钉生锈属 变化,颜色变为 ,质量比铁钉 (增大、减少)。
![]() 4.
这个规律叫质量守恒定律。
4.
这个规律叫质量守恒定律。
5.物质发生化学反应前后质量守恒,是因为反应前后 没有改变, 没有增减, 也没有变化
指点迷津
例1:小丁在化验室里检验一种新材料的组成时,发现新材料在纯氧中燃烧只生成CO2和H2O,于是他就认为新材料是由C、H、O三种元素组织的,他的判断正确吗?正确的判断应该是什么?
思路分析:根据质量守恒定律,在化学反应中,反应前后原子的种类没有改变,原子的个数没有增减,原子质量没有改变,因此反应物、生成物所含元素种类应该相同。由题意可知,生成物中含C、H、O三种元素。在该物质中肯定含有C、H两种元素,而氧元素可能全部来自氧气,也可能部分来自新材料,即该化合物可能含有氧元素。
答案:他的判断不正确,正确的判断应该是:一定含C、H元素,可能含O元素。
例2、下列说法能用质量守恒定律解释的是 ( )
A.镁带在空气中燃烧后,生成物的质量比镁带质量增加了
B.蜡烛完全燃烧后,生成水和二氧化碳的质量之和等于蜡烛质量
C.水的质量和受热变成水蒸汽的质量相等
D.高锰酸钾受热分解后,剩余固体的质量比反应物质量轻
思路分析:应用质量守恒定律分析和解释问题时,要注意:“发生反应的”“反应生成的”“质量总和”等关键词语。
A中是镁和氧气反应生成氧化镁,氧化镁的质量必然大于镁的质量,故A正确。
B中是蜡烛和氧气反应生成CO2和H2O,反应生成CO2和H2O的质量总和应该等于参加反应的蜡烛和氧气的质量之和,故B错误。
C中的变化不属于化学变化,所以不能用质量守恒定律来解释。
D中高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,所以剩余固体锰酸钾、二氧化锰的质量比高锰酸钾的质量轻,故D正确。
答案:A、D
基础评价
1.在2AB2+B2=2C 的反应中,C的化学式用AB表示为 。
2.在化学反应A+2B=C中,1.5gA与适量的B充分反应生成9.5gC,则参加反应的B的质量为 ( )
A.3g B.9.5g C.8g D.4g
3.根据植物光合作用的表达式:
水+二氧化碳 淀粉+氧气,可推
断产生淀粉的组成中一定含有的元素是( )
A.C、H、O B.C、H
C.C、O D.O、H
4.在化学反应前后下列各项①元素种类②原子种类③分子种类④物质种类⑤原子个数⑥分子个数⑦物质质量总和,一定发生改变的是 ;一定不变的有 ;可能改变的 。
5.下列观点你不赞成的是 ( )
A.化学变化的实质是原子的重新组合的过程
B.在与外界隔绝的条件下,物质间不论发生何种反应,其总质量保持不变。
C.在化学反应后,生成的各物质的质量总和,一定等于反应物的质量
D.化学变化前后,元素的种类不会改变
6.某化工厂实验室4.6g某物质在氧气中完全燃烧后生成CO28.8g和H2O 5.4g,则该有机物一定含有的元素是( )
A.C、H、O B.O、H
C.C、H D.以上三种说法都不正确
7.泰勒用A、B、C、D四种元素组成的化合物AD、BA、BCD,经过一系列十分复杂的化学反应,制造出人类现在还未知的物质x,于是泰勒召开新闻发布会,向记者说:“我制造出了一种新元素x”泰勒的话 因为 。
8.学生甲用天平称取氯化钠20g,学生乙发现他用的砝码生锈了,告诉甲称量不准确,试判断甲称取的氯化钠 20g(大于、小于或等于),理由是
。
9.下图形象地表示反应前反应物分子及其数目,则反应后不可能出现的情况是
 ( )
( )
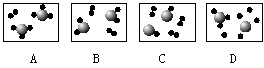
拓展探究
探究质量守恒定律
(1)你认为物质发生化学变化时其总质量是如何变化的?
(2)你能通过实验来检验你的假设吗?请把你的实验方案和大家交流讨论。
(3)听了同学的发言,你认为你设计的方案还需要修改吗?请完善你的设计方案。
化苑漫步
火山爆发
1.实验用品
氯酸钾,蔗糖,硝酸锶,硝酸钡,碳粉,玻璃棒重铬酸钾,硝酸钾,黄土,滴管,玻璃管,烧杯.
2.实验步骤
(1)将上述药品碾成粉末.(2)按下列比例配好.
绿色火焰 氯酸钾∶蔗糖∶硝酸钡∶重铬酸钾
5 10 8 10
洋红色火焰 氯酸钾∶蔗糖∶硝酸锶∶重铬酸钾
5 10 6 8
紫红色火焰爆炸
氯酸钾∶蔗糖∶硝酸钾∶木炭∶重铬酸钾∶硫磺
5 10 3 4 8 5
(3)将上述药品按不同比例混合好,堆成圆锥形,在尖部插一玻璃管.
(4)在药品表面覆盖一层湿润的黄土,堆成圆锥形,用手按紧,然后将玻璃管轻轻拔出,使之出现一个火山口.
(5)用滴管吸取浓硫酸3ml,从火山口注入,当听到有“吱一”声音时,便引燃了。
(6)从火山口喷出各种颜色的火花,并有绿色的“火山灰”沿坡泻下,妙趣横生,奥妙无穷。