05-06张家港市凤凰中学
第一学期初三化学期末模拟试卷
第1卷 选择题 (共38分)
一、选择题:以下各题,只有一个符合要求的答案。
1.下列俗语或成语所涉及的内容,有一项与化学变化或化学性质无关。它是--------- ( )
A.铁杵成针 B.蜡炬成灰 C.烈火成金 D.海枯石烂
2.人类生活需要能量。下列能量主要由化学变化产生的是----------------------( )
A.电熨斗通电发出的热量 B.电灯通电发出的光
C.水电站利用水力产生的电能 D.液化石油气燃烧放出的热量
3.“绿色化学工艺”是消除污染的重要手段,其理想工艺是反应物里的原子全部转化到欲制取的物质中。下列化学反应类型一定属于“绿色工艺”的是 ---------------------( )
A.置换反应 B.分解反应 C.化合反应 D.氧化反应
4.NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能。NO难溶于水,通常条件下极易与氧气反应。实验室收集NO的装置是------------------------------( )
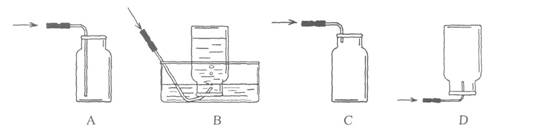
5.下列日常生活中的物质在混合后不能形成溶液的是-------------------------( )
A.少量味精放入水中 B.奶粉放入沸水中 C.蜂蜜放入水中配成饮料 D.食用油滴入汽油中
6.月球土壤含有大量氦3原子,它可能成为未来核能的重要原料。氦3原子核内有2个质子和1个中子。氦3原子结构示意图是-------------------------------------------( )

7.乙烯(化学式为C2H2)常用于水果催熟。下列说法正确的是------------------( )
A.乙烯的相对分子质量为13 B.乙烯中碳元素与氢元素的质量比为1︰2
C.乙烯的相对分子质量为26g D.乙烯中碳元素与氢元素的质量比为12︰1
8.洗涤剂能洗去餐具上的油污是因为洗涤剂------------------------------( )
A.有乳化功能 B.可溶解于水 C.可以溶解油污 D.可以稀释油污
9.生活中的下列现象不能说明气体溶解度随温度升高而减小的是------------------( )
A.烧开水时,沸腾前有气泡逸出 B.喝下汽水感到有气体冲出鼻腔
C.揭开啤酒瓶盖,有大量的泡沫溢出 D.夏季黄昏,池塘里的鱼常浮出水面
10.用质量分数为5%的氯化钠溶液配制50g质量分数为1%的氯化钠溶液,必不可少的一组仪器是( )
A.托盘天平、药匙、玻璃棒 B.量筒、烧杯、酒精灯
C.量筒、烧杯、玻璃棒 D.量筒、玻璃棒、漏斗
11.下列变化不属于化学变化的是----------------------------------------------( )
A.将煤隔绝空气加热以获得焦碳、煤焦油、焦炉气 B.植物的光合作用
C.将石油加热炼制成汽油、煤油、柴油等 D.煤和石油的形成过程
12.在一定温度下,某固态溶质(不含结晶水)的水溶液甲,经历如下变化:![]()
溶液甲 溶液乙 溶液丙,下列结论正确的是--( )
A.溶液甲可能是饱和溶液 B.溶液乙一定是不饱和溶液
C.溶液乙和溶液丙中的溶质质量分数可能相等
D.溶液丙若再蒸发5g水,析出的晶体一定大于2g
13.冬天,人们常用甘油溶液护肤,使皮肤保持湿润。质量分数为80%的甘油溶液护肤效果最佳。配制80%的甘油溶液500 g,所需甘油的质量为-----------------------------( )
A.80 g B.40 g C.400 g D.100 g
14.下面有关报道,不符合科学事实的是 ---------------------------------------( )
A.疏通煤气管道时,充入氩气引起火灾并发生爆炸
B.梅雨季节,一内部被虫蛀空的老柳树突然起火,烧毁
C.有易燃、易爆物的工作场所,严禁穿化纤衣物
D.一老汉因拉亮电灯,寻找煤气漏气处而引发大火,并引起爆炸
15.扑灭图书档案、贵重设备、精密仪器等火灾,不会留下任何痕迹而使物品损坏,最适宜的灭火器具是( )
A.高压水枪 B.液态二氧化碳灭火器 C.干粉灭火器 D.泡沫灭火器
16.某反应A+2B=C,若有15gA和一定量的B恰好完全反应,生成35gC,则参加反应的B物质的质量为---------------------------------------------------------------( )
A.20g B.10g C.15g D.无法计算
17.从防止空气污染考虑,下列实验应在通风橱中进行的是-------------------( )
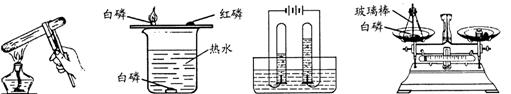
A.碘的受热和冷却 B.白磷的燃烧 C.电解水 D.白磷燃烧前后质量测定
18.10g高锰酸钾加热一段时间后,冷却称固体残留物质量为9.2g,则参加反应的高锰酸钾的质量为---------------------------------------------------------------------( )
A.0.8g B.10g C.7.9g D.8.5g
19.agA 物质与bgB物质发生化合反应生成C物质,则C的质量为--------------( )
A.等于(a+b)g B.小于(a+b)g C.大于(a+b)g D.不大于(a+b)g
第Ⅱ卷(共62分)
二、填空题
20.试简答或解释下列生活现象:
(1)春暖花开的季节里,人们在公园常能闻到怡人的花香,这说明
(2)为了便于运输和使用,通常将石油气加压变成液态储存在钢瓶中,这一事实说明
(3)维生素C在酸性环境中比较稳定,受热时易被破坏,因此采用 的食用方法,才能充分利用黄瓜中丰富的维生素C。
(4)冬天人们常在汽车的水箱中加入少量乙二醇之类的化合物,目的是为了
(5)扑灭森林大火时设置隔离带。理由是
21、用化学用语表示:
镁离子 两个氧离子 两个氮原子 两个氧分子
碳酸钠 氧化铁 硫酸根离子 两个硫酸分子 氯化钠中的阴离子 氧化铝 两个碳酸分子 氯原子结构示意图
硫酸在水中的电离方程式 在氯化钠溶液中存在的微粒
22.物质的变化过程中伴随着能量的变化。化学变化中通常伴随着能量转化,这是因为不同的物质包含的化学能大小不同,在化学变化中物质具有的化学能可以转变为热能、光能或电能等。
(1)举出一个环境中吸收热能的物理变化的例子 。
(2)镁条燃烧时,化学能转化为 能和 能。
(3)已知氢气在氧气中燃烧生成水的变化放出热能。根据能量守恒原理,反应前氢气和氧气的混合物所包含的化学能比反应后化学能 (填“高”或“低”),理由是
。
23.金属材料在生活中普遍使用。铁制品表面的锈要及时除去,这是因为铁锈
会加快铁制品的生锈。铝制品不需要除锈,这是因为铝表面能形成 可以阻止铝进一步氧化。
24.根据氢气、一氧化碳、二氧化碳和甲烷四种气体的性质,试在以下的用途中各选填一种对应气体的化学式。
(1)具有还原性,可用于冶炼金属的化合物是 (2)可供家庭用的气体化石燃料的主要成分
(3)加压降温后的固体可用作制冷剂的是 (4)燃烧产物无污染、未来可作高能燃料的是
25.用“>”、“=”、“<”填写:
(1)50℃时熟石灰的溶解度 20℃时熟石灰的溶解度; (2)生铁的含碳量 钢的含碳量;
(3)20℃时氯化钠的溶解度为36g,则20℃时氯化纳的饱和溶液中溶质的质量分数 36%;
 (4)100g无水酒精敞口放置于空气中,一段时间后,溶液的质量 100g;
(4)100g无水酒精敞口放置于空气中,一段时间后,溶液的质量 100g;
(5)质量分数为10%的蔗糖溶液100g,取出50g,剩下溶液的质量分数 10%;
26.在今年5月31日世界无烟日宣传活动中,某学
生设计了右图所示的实验装置。该装置中的澄清石灰
水可以检验香烟燃烧是否有 气体生成。为了使香烟燃烧产生的气体通过澄清石灰水,活塞应向 移动。
27.从金属的利用历史来看,先是青铜器时代,后是铁器时代,铝的利用是近100年的事。下列说法与这个先后顺序有关的是 (填写序号)。①地壳中金属元素的含量;②金属的活泼性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性。
28、有一瓶白色粉末A,取少量用水溶解后,得到无色的溶液。向该溶液中加入适量的稀盐酸,有无色气体B放出,同时得到无色溶液C;将B通入澄清的石灰水,出现白色沉淀D;往D中加入适量的稀盐酸,又放出气体B,同时得到无色溶液E;将上述无色溶液C蒸干,最后得到食盐的晶体。根据上述实验现象,推断有关物质分别是什么。写出它们的化学式:A B C D E
29.长途运输鱼苗时,人们常水中加入少量过氧化钙(CaO2)固体。甲、乙两位同学发现往水中投入过氧化钙时产生气泡。
提出问题:当把过氧化钙投入足量水中时,最终会生成什么物质呢?
进行猜想:甲同学认为,生成氧化钙和氧气;乙同学认为,生成氢氧化钙和氧气。
(1)你认为 同学的猜想是错误的,其理由是
(2)请设计一个实验方案来验证另一个同学的猜想是正确的,并填入下表空格中;
| 实验步骤及操作方法 | 预期的实验现象 | 结论 |
| 1、 取少量过氧化钙放入试管中,加足量水,
| 有氧气生成 | |
| 2、 |
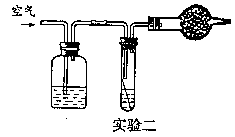 30 大多数金属材料在空气中都会生锈。铜锈的主要成分是铜绿[Cu2(OH)2CO3]。某同学利用下图所示的实验一进行实验,研究铜在空气中生锈的条件。一个月后该同学发现B装置中的铜丝生锈了,而A、C装置中的铜丝无明显变化。
30 大多数金属材料在空气中都会生锈。铜锈的主要成分是铜绿[Cu2(OH)2CO3]。某同学利用下图所示的实验一进行实验,研究铜在空气中生锈的条件。一个月后该同学发现B装置中的铜丝生锈了,而A、C装置中的铜丝无明显变化。
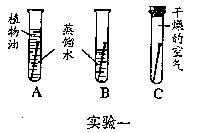
试回答下列问题:(1)该同学得出结论说:“铜生锈的原因是铜与空气中的氧气和水相互作用。”该同学得出的结论正确吗? ,你认为影响铜生锈的因素还可能有 。
(2)为了验证你的判断,现给你提供上图实验二所示的装置,从左到右每个仪器所盛放的试剂依次为 、 、 。
31、葡萄糖是一种有甜味、易溶于水的白色粉末状固体,化学式是C6H12O6。葡萄糖在人体内发生缓慢氧化转化为二氧化碳和水,并释放出热量。试回答:
(1)每个葡萄糖分子共有 个原子; (2)葡萄糖分子的相对分子质量
(3)葡萄糖中各元素的质量比C:H:O
(4)列式计算葡萄糖中碳元素的质量分数。
32、把100g大理石(杂质不参加反应)高温煅烧一段时间,固体质量减轻22g,把剩下的固体加入到过量的稀盐酸中,又产生气体11g,求此大理石中碳酸钙的质量分数。
33、根据氯化钠和硝酸钾的溶解度表,回答下列问题:
| 项目 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
| NaCl | 35.8g | 36.0g | 36.3g | 36.6g | 37.0g | 37.3g | 37.8g |
| KNO3 | 20.9g | 31.6g | 45.8g | 63.9g | 85.5g | 110g | 138g |
(1)写出KNO3 和NaCl具有相同溶解度时的温度范围: ;(限表中相邻两个温度之间);
(2)在60℃时,向50g水中加入60g KNO3,充分搅拌后所得溶液质量为多少?
(3)20℃时,200g溶质的质量分数为20%的氯化钠溶液加热蒸发掉60 g水后降温至20℃,试求此时从溶液中析出的氯化钠的质量。
参考答案
第1卷
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | D | C | B | B | D | D | A | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| 答案 | C | C | C | A | B | A | B | C | D |
第Ⅱ卷
20.(1)构成物质的微粒在不断地运动 (2)构成石油气的微粒之间有一定的空隙 (3)填醋凉拌 (4)降低水的凝固点、防止水箱中的水结冰 (5)将可燃物与燃烧区隔离
21略
22、(1)冰雪融化时需吸收热量(2)光、热
(3)高, 反应物具有的化学能等于生成物具有的化学能和放出热能之和
23.疏松多孔,易吸水 致密氧化物薄膜
24.(1)CO
(2)CH4
(3)CO2
(4) H2
25.< > < < =
26、二氧化碳(CO2) 右(或外)
27、②④
28.Na2CO3 CO2 NaCl CaCO3 CaCl2
29、(1)甲 氧化钙与水还会继续反应生成氢氧化钙
(2)1、将带火星的木条伸入试管中 木条复燃 2、向所得的溶液中通入二氧化碳气体 溶液变浑浊 有氢氧化钙生成
30.(1)不正确 CO2(2)澄清石灰水 蒸馏水 生石灰
31.(1)24 (2)180 (3)6:1:8 (4)40%
32、75%
33、(1)20℃--30℃ (2)105g (3) 4g