习题精选
一、选择题
1.在一定温度时,某溶质的溶解度为S克,则该温度时饱和溶液中溶质的质量分数( )
A 大于S% B 等于S% C 小于S% D 无法判断
2.在20℃时,向100克饱和食盐水(食盐的质量分数是26.5%)中加入5克食盐,在温度不变的情况下溶液中食盐的质量分数为( )
A 24.5% B 26.5% C 28.5% D 无法计算
3.把30克质量分数为20%的氢氧化钠溶液,加水稀释到100克,取出稀释后溶液20克,此溶液中NaCl的质量分数为( )
A 5% B 6% C 3% D 2%
4.把400克质量分数为20%食盐水稀释成质量分数为10%的溶液,需加水( )
A 100克 B 200克 C 400克 D 800克
5.20℃时NaCl在水中的溶解度是36g。在该温度下,50g水中放入20gNaCl,溶解后所得溶液中NaCl的质量分数为( )
A 28.6% B 26.5% C 40% D 30%
6.将溶质的质量分数为a%的溶液mg,稀释成溶质的质量分数为b%的溶液,需加水的质量为( )
A am/b g B m(a-b)/b g
C a/mb g D (a-b)/m g
7. t℃时将一定质量的某物质的不饱和溶液分成三份,分别加热蒸发溶剂。然后,把温度降至t℃。已知从三份溶液中蒸发的溶剂分别为10g、20g、30g,析出晶体(不含结晶水)分别为ag、bg、cg,则a、b、c,三者的关系是( )
A c=2b-a B c=a+b
C c=a+2b D c=2a+b
8.有xg20%A溶液,若要将浓度降到10%,应采取的措施是( )
A 加入一倍的溶剂 B 加入的溶剂
C 加入2xg5%A溶液 D 加入xg20%A溶液
9.20℃NaCl的溶解度是36g,在该温度下,将20gNaCl溶于100g水中配成溶液甲,取20g甲溶液,加入6gNaCl晶体,得到乙溶液,则甲、乙两溶液的溶质质量分数正确的一组是( )
A 甲—16.7% 乙—35.9% B 甲—20% 乙—35.9%
C 甲—20% 乙—26.5% D 甲—16.7% 乙—26.5%
10.在20℃时,A物质的不饱和溶液,浓度为10%,如再加入5gA或蒸发掉32.26g水,都可成为饱和溶液,则20℃时,A的溶解度为( )
A 13.4g B 15.5g C 16.7g D 无法计算
11.在100g溶液中加入20%的溶液100g后浓度为12%,则原溶液的浓度为( )
A 2% B 4% C 8% D 10%
12.现有40℃时KNO3的饱和溶液82.0g,当温度下降至10℃时,溶液质量为60.5g,此时需加水102.4g才能把析出的晶体全部溶解,则40℃时KNO3的溶解度是
A 32g B 64g C 40.5g D 21.5g
13.将60℃的硫酸铜饱和溶液100克,冷却到20℃,下列说法正确的是
A 溶液质量不变 B 溶剂质量发生变化
C 溶液为饱和溶液,浓度不变 D 有晶体析出,溶剂质量不变
14.某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是
A 30% B ![]() ×100%
×100%
C 26.5% D ![]() ×100%
×100%
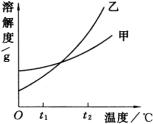
15.下图是甲、乙两种固体物质的溶解度曲线,下列叙述错误的是( )。
A.![]() ℃时,甲饱和溶液的质量分数大于乙饱和溶液的质量分数
℃时,甲饱和溶液的质量分数大于乙饱和溶液的质量分数
B.![]() ℃时,甲的溶解度一定小于乙的溶解度
℃时,甲的溶解度一定小于乙的溶解度
C.当乙中含有少量甲时,可用结晶法提纯乙
D.当温度由![]() ℃降到
℃降到![]() ℃时,一定是乙溶液中析出的晶体多
℃时,一定是乙溶液中析出的晶体多
16.25℃时向100g质量分数为5%的![]() 溶液中加入5g KCl粉末,完全溶解后,溶液中
溶液中加入5g KCl粉末,完全溶解后,溶液中![]() 的质量分数将(
)。
的质量分数将(
)。
A.增大 B.减小 C.不变 D.无法判断
17.将20克![]() 全部溶解在100克水中形成的溶液,下列说法正确的是( )
全部溶解在100克水中形成的溶液,下列说法正确的是( )
A.溶剂为20克 B.![]() 的溶解度为20克
的溶解度为20克
C.溶液为120克 D.溶液中溶质质量分数为20%
18.实验室配制溶质质量分数一定的某溶液,用到的仪器可能有①托盘大平 ②烧杯 ③玻璃棒 ④试管 ⑤药匙 ⑥胶头滴管 ⑦量筒。正确的一组是( )
A.①②③④ B.①②③⑤ C.②③④⑦ D.②③⑥⑦
19.有100克10%的硝酸钠溶液,若将其溶质的质量分数增大一倍应采取的方法是()
A.蒸发掉溶剂的一半 B.加入10克硝酸钠
C.蒸发掉50克水 D.加入100克10%的硝酸钠溶液
20.把200克20%的食盐水稀释成10%的溶液需要加水( )
A.50克 B.100克 C.150克 D.200克
21.将2.5克溶质溶于47.5克水中,要使所得溶液中溶质的质量分数增大一倍,可采用的方法是①蒸发掉25克水 ②蒸发掉23.75克水 ③再加入2.5克溶质 ④再加入50克质量分数为15%的该溶液,其中正确的是( )
A.①② B.②③ C.①④ D.①③
22.把20%的硝酸钠溶液50克,加水稀释至200克,则稀释后溶液中溶质的质量分数为( )
A.12% B.6% C.20% D.5%
23.10℃时![]() 的溶解度为80克,该温度下,将45克
的溶解度为80克,该温度下,将45克![]() 放入50克水中,充分溶解后,所得溶液中溶质的质量分数约为( )
放入50克水中,充分溶解后,所得溶液中溶质的质量分数约为( )
A.80% B.44.4% C.90% D.47.4%
24.现有20℃时![]() 的饱和溶液200克,欲改变其溶质的质量分数,可采取的措施为( )
的饱和溶液200克,欲改变其溶质的质量分数,可采取的措施为( )
A.将溶液升温至50℃ B.将该溶液降温至10℃
C.温度不变,加入10克![]() 晶体 D.温度不变,蒸发掉10克水
晶体 D.温度不变,蒸发掉10克水
25.某一接近饱和的食盐溶液,在下列操作中,溶液的溶质质量分数保持不变的是( )
A.降温,使其达到饱和
B.温度不变,加入10克水
C.温度不变,蒸发溶剂,使其达到饱和
D.温度不变,加入食盐晶体使其达到饱和
二、填空题
1.某温度下,在100g水中加入一定质量的无水硫酸铜,或加入一定质量的硫酸铜晶体,完全溶解后所得溶液的溶质质量分数相等。则所加两种物质的质量关系为________。
2.注射用链霉素试验针的药液配制方法如下:
①把1.0g链霉素溶于水制成4.0mL溶液a。
②取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
③取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
④取0.2mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中药液很稀,其密度都可近似看做是![]() 。试求:
。试求:
(1)溶液a中溶质的质量分数________。
(2)最终得到的试验针药液(溶液d)中溶质的质量分数________。
(3)1.0g链霉素可配制________mL试验针药液。
3.100g质量分数为20%的盐酸中,含溶质________g。要配制100g这种盐酸,需要质量分数为37%的盐酸(密度为![]() )________mL(最后结果保留一位小数)。
)________mL(最后结果保留一位小数)。
4.在20℃时,取![]() 和
和![]() 各10g,分别与90g水充分混合,所得溶液的溶质质量分数为10%的是________溶液。
各10g,分别与90g水充分混合,所得溶液的溶质质量分数为10%的是________溶液。
5.一份溶质质量分数为2%的![]() 溶液蒸发掉40g水后,其溶质的质量分数变为10%,则原溶液中溶质的质量为________g。把160g质量分数为15%的硝酸钠溶液稀释成质量分数为10%的硝酸钠溶液,需加水________g。
溶液蒸发掉40g水后,其溶质的质量分数变为10%,则原溶液中溶质的质量为________g。把160g质量分数为15%的硝酸钠溶液稀释成质量分数为10%的硝酸钠溶液,需加水________g。
6.向一定量的盐酸中,加入硝酸银溶液到恰好完全反应,过滤,所得溶液的质量等于所加硝酸银溶液的质量,则盐酸溶液中溶质的质量分数为________。
三、计算题
1.蒸干15克NaCl溶液得到1.2克NaCl,计算原溶液中NaCl的质量分数。
2.在一定温度时,NaCl饱和溶液的质量是12g,把它蒸干后,得到3.2gNaCl,计算:
(1)这一温度下NaCl的溶解度
(2)该温度时NaCl饱和溶液中溶质的质量分数
(3)配制该温度时NaCl饱和溶液1000g,需水和NaCl各多少g?
3.在10℃时, ,计算10℃时饱和溶液中溶质的质量分数。在50℃时,饱和溶液中溶质的质量分数是33.3%,计算50℃时的溶解度。
4.在80g质量分数为15%溶液里加入20g水或20g,计算这两种方法制成的两种溶液中溶质的质量分数。
5.配500ml质量分数为10%NaOH(密度为),需NaOH和水各多少g?
6.把100g质量分数为98%稀释成质量分数为10%,需水多少g?
7.实验室需要配500g质量分数为10%的盐酸,需要质量分数为38%的盐酸(密度是)多少ml?
8.100g某浓度的溶液恰好跟13g锌完全反应,试计算这种溶液中溶质的质量分数。
9.200ml质量分数为38%的盐酸跟足量的大理石反应,可生成多少L?(质量分数为38%盐酸的密度是,的密度按计算)。
10.30g可以跟150克溶液恰好完全反应,计算:
(1)可制得多少g?把溶液蒸干,得到多少g?
(2)这种溶液中溶质的质量分数是多少?
(3)100g这种稀释成质量分数为20%的,需加水多少g?
11.100g稀中滴入100g溶液,恰好完全反应,生成沉淀23.2g,求稀的百分比浓度,溶液的百分比浓度。
12.20℃时,把一定量20%的某物质的水溶液加热蒸发掉10g水,再降到20℃,析出2g溶质,溶液浓度变为24%,求20℃时,该物质的溶解度。
13.用60%的NaOH溶液与10%NaOH溶液混合,配制20%的NaOH溶液150g,求需60%的NaOH溶液和10%的NaOH溶液各多少g。
四、实验题
如下图是配制80克质量分数为20%的氯化钾溶液的操作过程示意图。
试回答:
(1)B操作中应称量氯化钾的质量是________,放好砝码和游码后,向托盘中加入氯化钾时,若指针偏向分度盘的左边,应进行的操作是________。
(2)D操作应选用________毫升的量筒(从10mL、100mL中选择),量水时,量筒必须平放,视线要根量筒凹液面的________处保持平衡。
(3)E操作的作用是________________________。

五、创新题
1.将质量分数为50%和30%的氯化钠溶液混合,配制成质量分数为40%的氯化钠溶液,应取这两种溶液的质量比为( )
A.1:3 B.1:1 C.5:3 D.3:1
2.对100克溶质质量分数为10%的某物质的溶液,分别进行如下操作:①加入10克水;②加入10克同种溶质,且完全溶解;③加入溶质质量分数为10%的同种溶质的溶液10克;④蒸发掉10克水,无晶体析出,操作后的四种溶液的溶质质量分数由小到大的顺序是( )
A.①②③④ B.①③④② C.④③②① D.④②③①
3.含硫酸质量分数为70%和10%的硫酸溶液等体积混合,所得硫酸溶液的质量分数为( )
A.大于40% B.小于40% C.等于40% D.无法确定
4.在25℃时,向足量的饱和碳酸钠溶液中加入1.06克无水碳酸钠,搅拌静置后,最终所得晶体的质量为( )
A.等于1.06克 B.大于1.06克或小于2.86克
C.等于2.86克 D.大于2.86克
5.将60℃溶质的质量分数为80%的硝酸铵溶液400克,恒温蒸发掉5克水,析出10.5克晶体,则60℃时硝酸铵的溶解度是( )
A.105克 B.21克 C.400克 D.以上都不对
6.如图所示A物质的溶解度曲线,如图推断A物质( )
A.一定是固体 B.一定是气体
C.可能是气体 D.无法确定
答案:
一、1.C 提示:该溶液溶质的质量分数是S/(100+S),此数值小于S% 。
2.B 提示:对于饱和溶液而言,质量分数是固定的。
3.B 提示:稀释前后溶质的质量是不变的,只是溶液质量发生改变。
4.C 提示:稀释前后溶质的质量是不变的,只是溶液质量发生改变。
5.B 提示:由题意可知,该溶液为饱和溶液,所以溶质的质量分数是26.5%。
6.B 提示:稀释前后溶质的质量是不变的
7.A 提示:第一份蒸发掉10 g水析出a g;第二份蒸发掉10 g水时,先析出a g,再蒸发掉10 g水时,又析出(b-a)g;第s三份蒸发掉10 g水时,先析出a g,又蒸发掉10 g水时,又析出(b-a)g,再蒸发掉10 g水时,再析出(b-a)g,所以共析出溶质c=a+(b-a)+(b-a)=2b-a
8.C 提示:稀释前后溶质的质量是不变的
9.D 提示:按照溶质的质量分数的方法进行计算,注意乙溶液是饱和溶液。
10.B
11.B 提示:设原溶液的浓度为x,则100(x+20%)=(100+100)×12%
12.B
13.B提示:硫酸铜饱和溶液析出的是五水硫酸铜晶体,将部分水带出。
14.C提示:添加氯化钠和水的溶液是饱和溶液。
15.D
16.B
17.答案:C 点拨:20克![]() 全部溶解在100克水中会形成20克+100克=120克溶液。
全部溶解在100克水中会形成20克+100克=120克溶液。
18.答案:B 点拨:这是溶液配制与实验技能相结合的题。
19.答案:C 点拨:解此类题目,最简单的方法是:把溶液分成溶质、溶剂两部分,按题目所说的进行计算。
20.答案:D 点拨:溶液稀释问题的关键是溶液在稀释前后,溶质的质量不变。
21.答案:C 点拨:首先要算出原溶液中溶质的质量分数,然后再进行计算。
22.答案:D 点拨:通过计算,很容易得出答案,可设稀释后溶液中溶质的质量分数为x,根据溶液稀释前后,溶质的质量不变,可得50克×20%=200克·x,x=5%
23.答案:B 点拨:解此类题目的关键是弄准45克![]() 是否都溶于50克水中,可设溶解了x,则
是否都溶于50克水中,可设溶解了x,则![]()
![]()
所得溶液为40克+50克=90克,则溶质质量分数为![]() 。
。
24.答案:B 点拨:温度降低时,会有溶质从溶液中析出,溶质质量变小,溶剂质量不变,溶质的质量分数也会改变。
25.答案:A 点拨:在降温前后,溶液中溶质、溶剂的质量都没改变,溶液中溶质的质量分数也不会改变。
二、1.提示:首先要明确:①所得溶液均为![]() 溶液;②前者加入无水硫酸铜
溶液;②前者加入无水硫酸铜![]() 质量若为
质量若为![]() ,则溶液中溶质质量即为
,则溶液中溶质质量即为![]() ,溶液质量为
,溶液质量为![]() ;③后者加入的硫酸铜晶体是结晶水合物。其质量若为
;③后者加入的硫酸铜晶体是结晶水合物。其质量若为![]() ,则溶质质量
,则溶质质量![]() ,溶液质量为
,溶液质量为![]() 。然后利用“所得溶液的溶质质量分数相等”这一条件找出
。然后利用“所得溶液的溶质质量分数相等”这一条件找出![]() 与
与![]() ,即
,即![]() 与
与![]() 的质量的关系。
的质量的关系。
解:设![]() 质量为
质量为![]() ,
,![]() 的质量为
的质量为![]() 。
。
溶液中溶质质量分数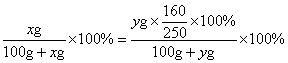 ,则
,则
![]() 或
或![]() (合理答案均可)。
(合理答案均可)。
答:![]() 或
或![]() (其他合理答案均可)。
(其他合理答案均可)。
2.提示:解答此题第一步是基础,且后面每一步不能出错,主要是用溶质质量在稀释前后不变来解答且注意②~④步中每次稀释至1mL。
答:(1)25%;(2)0.05%;(3)2000。
3.提示:此题的第二问是溶液配制问题,列方程要根据配制前后溶质的量不变。但题目中所要求的是溶液体积,要注意用![]() 来换算。
来换算。
解:设需要质量分数为37%的盐酸的体积为V。
![]()
![]() 。
。
答:20g,45.4mL。
4.提示:此题的计算很简单,但是要知道![]() 和
和![]() 两种物质的溶解性不一样,前者为易溶物,后者为微溶物,故10g
两种物质的溶解性不一样,前者为易溶物,后者为微溶物,故10g![]() 在90g水中不能全部溶解。
在90g水中不能全部溶解。
答:![]() 。
。
5.提示:对蒸发溶剂、浓缩溶液(无晶体析出)和加水稀释溶液的计算,要抓住“溶质质量不变”的隐含条件。根据溶质质量=溶液质量×溶质质量分数进行计算。①若设原溶液的质量为![]() ,则原溶液中溶质质量
,则原溶液中溶质质量![]() ,蒸发40g水以后溶液中溶质质量
,蒸发40g水以后溶液中溶质质量![]() ,即:
,即:![]() ,解得
,解得![]() ,故原溶液中溶质质量
,故原溶液中溶质质量![]() ;②若设需加水的质量为
;②若设需加水的质量为![]() ,稀释前溶质质量
,稀释前溶质质量![]() ,稀释后溶质质量
,稀释后溶质质量![]() ,即:
,即:![]() ,得
,得![]() 。
。
答:1g;80g。
6.提示:根据质量守恒定律分析反应:
![]()
则:盐酸的质量+硝酸银溶液质量=氯化银质量+硝酸溶液质量。由于题中条件“所得溶液的质量等于所加硝酸银的溶液质量”,可推知解答本题的关键:盐酸质量=生成的氯化银的质量。若假设生成氯化银质量为![]() ,则有下列关系:
,则有下列关系:

盐酸溶液的溶质质量分数![]()
答:25.4%。
三、1.8%
2.(1)36.4g (2)26.7% (3)需要水733g,NaCl267g
3.10℃时的溶质的质量分数为24.8%,50℃时溶解度为49.9g。
4.若加20g水,溶质的质量分数为12%
若加20g,溶质的质量分数为32%
5.需要NaOH55g,水495g
6.880g
7.111mL
8.19.6%
9.27.6L
10.(1)产生0.92g,得到74.3g
(2)30%
(3)50g
11.9.8%,20.8%
12.31.6g
13.30g 120g
四、(1)16克;减少氯化钾的质量 (2)100;最低 (3)加速氯化钾的溶解。
点拨:(1)80克÷20%=16克。这是关于溶质质量分数的一步计算。根据称物体时的“左物右码”,指向左边,说明物质的质量稍大,所以要减小质量。(2)首先确定D操作是量水,此实验需水的体积为(80克-16克)×1克/厘米3=64毫升,所以应选用100毫升的量筒。(3)加快氯化钾溶解
五、1.答案:B 点拨:解此类题目的关键是抓住溶液混合前后溶质的质量不变。
2.答案:C B 点拨:解此类题目需要一一计算,计算出各项中的溶质质量分数,再进行比较。
3.答案:A 点拨:设质量分数为70%的硫酸质量为x,10%的质量为y。则
![]()
![]()
![]()
![]() ,
,
由题意可得![]() ∴
∴![]() 。
。
4.答案:D 点拨:向饱和的![]() 溶液中加入1.06克无水
溶液中加入1.06克无水![]() 后,从溶液中析出的晶体是
后,从溶液中析出的晶体是![]() ,由于带出了结晶水,使饱和溶液中溶剂的量减少了,溶剂减少又要进一步析出晶体,因此,最后所得晶体的质量应大于与1.06克
,由于带出了结晶水,使饱和溶液中溶剂的量减少了,溶剂减少又要进一步析出晶体,因此,最后所得晶体的质量应大于与1.06克![]() 对应的
对应的![]() 的质量。
的质量。
设1.06克![]() 对应的
对应的![]() 的质量为x克,根据:
的质量为x克,根据:
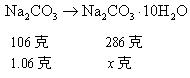
![]()
实际析出的![]() 质量应大于2.86克。
质量应大于2.86克。
5.答案:D 点拨:原溶液中![]() 的质量=400×80%=320(克)
析出晶体后溶液中水的质量=400-320-5=75(克),析出晶体后剩余
的质量=400×80%=320(克)
析出晶体后溶液中水的质量=400-320-5=75(克),析出晶体后剩余![]() 的质量=320-10.5=309.5(克),则60℃时,
的质量=320-10.5=309.5(克),则60℃时,![]() 的溶解度
的溶解度![]() 。溶解度是指在一定温度下,达到饱和状态时100克水中所溶解溶质的质量。60℃时,溶质的质量分数为80%的硝酸铵溶液不一定是饱和溶液,只有当蒸发5克水析出10.5克晶体后的溶液才是饱和溶液。
。溶解度是指在一定温度下,达到饱和状态时100克水中所溶解溶质的质量。60℃时,溶质的质量分数为80%的硝酸铵溶液不一定是饱和溶液,只有当蒸发5克水析出10.5克晶体后的溶液才是饱和溶液。
6.答案:B 点拨:解答此类题可通过固定其中一个因素来讨论另一个因素与溶解度的关系,若将温度固定,如取温度为10℃时,随着压强的增大,溶解度也随着增大;当固定压强时,取任意一条曲线来看,随着温度的升高溶解度却减小。因此,A物质一定是气体。