化 学 试 题
| 考生须知 | 1.本试题共四个大题,满分80分。考试时间60分钟。 2.试题中所有答案填涂、书写在答题卡上。在试卷上作答无效。 3.认真填写学校、姓名和报名号。 4.试题中有关计算的最后结果,均保留一位小数。 |
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24
Cl—35.5 Ca—40 Fe—56 Cu—64
一、选择题(下列各题只有一个选项符合题意,每小题2分,共32分)
1.下列变化中,属于化学变化的是
(A)酒精挥发 (B)矿石粉碎
(C)冰雪融化 (D)白磷自燃
2.下列物质中,属于混合物的是
(A)空气 (B)石墨 (C)水银 (D)胆矾
3.下列物质中,属于盐的是
(A)H2SO4 (B)CaCO3 (C)NaOH (D)HgO
4.电解水的实验证明,水是由
(A)氢气和氧气组成 (B)氢分子和氧分子构成
(C)氢元素和氧元素组成 (D)氢分子和氧原子构成
5.下列关于分子和原子的说法中,不正确的是
(A)分子、原子都在不停地运动
(B)分子、原子都是构成物质的微粒
(C)原子是不能再分的最小微粒
(D)分子是保持物质化学性质的最小微粒
6.下列物质在氧气中燃烧,能产生明亮的蓝紫色火焰的是
(A)红磷 (B)硫粉 (C)铁丝 (D)氢气
7.下列物质中,不能与稀硫酸反应的是
(A)Cu (B)CuO
(C)Cu(OH)2 (D)Na2CO3
8.铁是一种应用广泛的金属,下列有关铁的说法中,正确的是
(A)铁丝在氧气中燃烧生成氧化铁
(B)铁在干燥的空气中容易生锈
(C)铁是地壳里含量最多的金属元素
(D)用铁锅炒菜可使食物中增加微量铁元素
9.地球上可以直接利用的淡水不足总水量的1%,节约用水、保护水资源是每个公民应尽的义务。下列做法中,不正确的是
(A)北京市政府给每户居民发放节水龙头
(B)用喷灌、滴灌的方法浇灌园林或农田
(C)将工业废水处理达标后排放
(D)将生活污水任意排放
10.“西气东输”是我国西部大开发中的一项重点工程,输送的是当今世界上最重要的一种气体化石燃料,该气体的主要成分是
(A)氢气 (B)一氧化碳
(C)甲烷 (D)二氧化碳
11.遇到下列情况,采取的措施正确的是
(A)浓硫酸不慎滴在手上,立即用大量水冲洗
(B)酒精灯不慎打翻起火,立即用水浇灭
(C)炒菜时油锅着火,立即盖上锅盖
(D)发现家中天然气泄漏,立即打开抽油烟机
12.粗盐提纯的实验中,主要操作顺序正确的是
(A)过滤、溶解、蒸发 (B)溶解、蒸发、过滤
(C)蒸发、溶解、过滤 (D)溶解、过滤、蒸发
13.下列物质溶于水,所得溶液的pH大于7的是
(A)干冰 (B)生石灰 (C)食醋 (D)食盐
14.把铁粉、锌粉放入硝酸银和硝酸铜的混合溶液中,充分反应后过滤,滤出的金属中一定含有
(A)Fe (B)Cu (C)Ag (D)Cu和Ag
15.下列物质中,分别与AgNO3、CuSO4、K2CO3三种溶液混合时,均有白色沉淀生成的是
(A)盐酸 (B)硝酸钙溶液
(C)氢氧化钠溶液 (D)氯化钡溶液
16.将氯化钾、氯化铁和硫酸钡的固体混合物逐一分离,应选用的一组试剂是
(A)水、硝酸银溶液、稀硝酸 (B)水、氢氧化钠溶液
(C)水、氢氧化钾溶液、盐酸 (D)水、氢氧化钾溶液
二、填空题(每空1分,共26分)
17.用化学符号表示:3个氧分子__________,2个铝原子__________,1个钠离子__________。
18.某元素的原子结构示意图为![]() ,其原子核内的质子数为__________,该元素属于__________元素(填“金属”或“非金属”)。
,其原子核内的质子数为__________,该元素属于__________元素(填“金属”或“非金属”)。
19.二氧化氮是大气污染物之一。通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的__________性质(填“物理”或“化学)。
20.吸毒严重危害人体健康与社会安宁,是世界的一大公害。“摇头丸”是国家严禁的一种毒品,化学式为C9H13N,它由__________种元素组成,其相对分子质量为__________。
21.氨是生产氮肥的原料,氨水也可直接做氮肥使用。氨(NH3)中,氮元素的化合价为__________。
22.现有盐酸、熟石灰、烧碱、食盐四种物质,其中能用于金属除锈的是__________,能用于改良酸性土壤的是__________。
23.为了延长白炽灯的使用寿命,灯泡里放有极少量的红磷做脱氧剂,其作用的化学方程式为__________,反应的基本类型是__________。
24.二氧化碳是常用的灭火剂,但金属镁着火却不能用二氧化碳扑灭,因为镁能在二氧化碳中继续燃烧,生成黑色和白色两种固体粉末。写出该反应的化学方程式_______________。
25.检验长期敞口放置的氢氧化钠溶液是否变质,可选用的试剂是__________,如果变质了,请选择适宜试剂除去杂质,其化学方程式为__________。
26.下图是固体A的溶解度曲线,请回答:
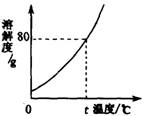
(1)t℃时,A的饱和溶液中溶质的质量分数为__________。
(2)若将上述饱和溶液转化为不饱和溶液,可采用的方法有____________________。
27.汽车、电动车一般要使用铅酸蓄电池。某铅酸蓄电池用的酸溶液是溶质质量分数为28%的稀硫酸,若用几溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3) __________L,配得稀硫酸的质量为__________kg。
28.有一种混合气体,可能由H2、CO、CO2和HCl中的一种或几种组成,将此混合气体通入澄清的石灰水中,未见浑浊,但气体总体积明显减小;再将剩余的气体在氧气中燃烧,燃烧产物不能使无水硫酸铜变蓝。则原混合气体中一定含有__________,可能含有__________。
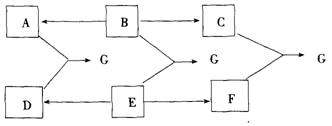
29.A、B、C、D、E、F分别为酸、碱、盐中的6种物质,它们都易溶于水,且有如下图所示的转化关系。已知G是一种难溶于稀硝酸的白色沉淀。
(1)试推断B、E、C的化学式:B__________,E__________,C__________。
(2)写出A与D反应的化学方程式:______________________________。
三、实验题(每空1分,共14分)
30.根据下面的实验装置图回答问题:
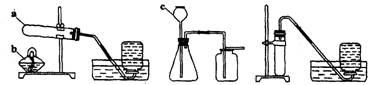
装置A 装置B 装置C
(1)写出图中标有字母的仪器名称:a__________,b__________,c__________。
(2)实验室制取氧气应选用的装置是(填装置序号,下面) __________,制取氢气应选用的装置是__________,制取二氧化碳应选用的装置是__________;检验二氧化碳是否收集满时,应将__________放在集气瓶口。
(3)用氯酸钾和二氧化锰制取氧气的化学方程式为__________,实验室制取氢气最适宜的一组药品为____________________。
31.某同学用左图所示的装置验证质量守恒定律时,将锥形瓶倾斜,使稀盐酸与大理石接触,待充分反应后,发现天平指针指向__________ (填“a方向”、“b方向”或“0”),其原因是__________。

32.现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取该样品10g,并用右图所示的装置进行实验,得到如下两组数据:
| 反应前 | 氧化铁安全反应后 | |
| A组 | 玻璃管和氧化铁样品的质量43.7g | 玻璃管和固体物质的质量41.3g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.2% |
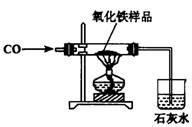
试回答:
(1)你认为,应当选择__________组的实验数据来计算样品中氧化铁的质量分数,计算的结果为__________。
(2)这位同学所用实验装置的不足之处是__________。
四、计算题(每小题4分,共8分)
33.用氢气还原氧化铜,当4g氧化铜完全被还原时,求参加反应的氢气的质量。
34.将20g不纯的氯化镁样品(杂质不溶于水,也不参加反应)跟一定量的氢氧化钠溶液恰好完全反应,得到溶质质量分数为10%的溶液234g。求:
(1)样品中氯化镁的质量;
(2)加入的氢氧化钠溶液中溶质的质量分数。
答案:
一、选择题(每小题2分,共32分)
1. D 2. A 3. B 4. C 5.C 6. B 7. A 8. D
9. D 10. C 11.C 12. D 13. B 14. C 15. D 16. C
二、填空题(每空1分,共26分)
17. 3O2 2Al Na+ 18. 17 非金属 19. 物理 20. 3 135
21. –3价 22. 盐酸 熟石灰 23.
4P+5O2![]() 2P2O5 化使反应
2P2O5 化使反应
24. 2Mg+CO2![]() 2MgO+C
2MgO+C
25.盐酸(常见的酸,含Ca2+、Ba2+的可溶性的盐碱均可)
Na2CO3+Ca(OH)2![]() CaCO3↓+2NaOH
CaCO3↓+2NaOH
或Na2CO3+Ba(OH)2![]() BaCO3↓+2NaOH
BaCO3↓+2NaOH
26.(1)44.4% (2)升温、加水(或加不饱和溶液)
27. 4.6 6.4(或6.44) 28. CO、HCl CO2
29.(分析)
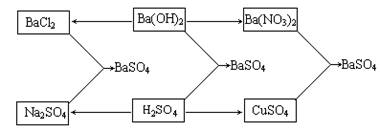
(1)Ba(OH)2 H2SO4 BaSO4
(2)BaCl2+Na2SO4→BaSO4↓+2NaCl
(合理、正确得分)
三、实验题(每空1分,共14分)
30.(1)试管 酒精灯 长颈漏斗
(2)A C B 燃着的木条
(3)2KClO3![]() 2KCl+3O2↑ 锌和稀硫酸
2KCl+3O2↑ 锌和稀硫酸
31.b方向 气球胀大,所受空气浮力增大
32.(1)A 80% (2)缺少尾气处理装置
四、计算题(每小题4分,共8分)
33.解:设参加反应的氢气的质量为x
CuO+H2![]() Cu+H2O………………………………………………1分
Cu+H2O………………………………………………1分
80 2………………………………………………………………1分
4g x………………………………………………………………1分
![]() =
=![]() ………………………………………………………………1分
………………………………………………………………1分
x=![]() =0.1g……………………………………………………1分
=0.1g……………………………………………………1分
答:参加反应的氢气的质量为0.1g。
34.解1:设样品中氯化镁的质量为x,消耗氢氧化钠的质量为y
MgCl2+2NaOH![]() Mg(OH)2↓+2NaCl
Mg(OH)2↓+2NaCl
95 80 117
x y 234×10%
x=![]() =19g……………………………………………1分
=19g……………………………………………1分
y=![]() =16g………………………………………………1分
=16g………………………………………………1分
加入的氢氧化钠溶液中溶质的质量分数为:
![]() ×100%=7.1%………………………………2分
×100%=7.1%………………………………2分
解2:设生成氢氧化镁的质量为z
MgCl2+2NaOH![]() Mg(OH)2↓+2NaCl
Mg(OH)2↓+2NaCl
95 80 58 117
x y z 234g×10%
(x、y的解法同上)……………………………………………………2分
z=![]() =11.6g
=11.6g
加入的氢氧化风俗溶液中溶质的质量分数为:
![]() ×100%=7.1%…………………………………2分
×100%=7.1%…………………………………2分
答:氯化镁的质量为19g,氢氧化钠溶液中溶质的质量分数为7.1%。
(其它解法正确得分)