2005-2006学年度初三年级化学期末考试试卷
可能用到的相对原子质量:H—1;C—12; O—16 ;Na—23 ;Mg—24;Cl—35.5;
Ca—40; Fe—56
一、选择题(本题包括20小题,每小题2分,共40分。)每小题只有一个选项符合题意,请将符合题意的选项的序号填入括号内
1.使用材料的变化标志着人类文明的进步。下列用品的材料不是通过化学变化制取的是( )
A.铁器 B.青铜器 C.塑料器具 D.石器
2.下图中的事例能说明分子间的间隙变小的是( )
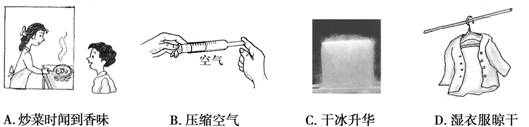
3.市场上销售的加碘食盐、含氟牙膏、高钙牛奶、补铁酱油等,说明了化学与人体的健康密不可分。这里的碘、氟、钙、铁是指………………………………………………… ( )
A.单质 B.分子 C.元素 D.原子
4. 高铁酸钾是一种新型、高效、多功能的“绿色”水处理剂,已知其化学式为K2FeO4,则Fe元素的化合价为 ( )
A.+2 B.+4 C.+5 D.+6
5.根据你的生活经验和所学知识判断,下列做法错误的是()
A.电线短路着火,立即用水浇灭
B.加油站、面粉厂贴有“禁止烟火”的标志
C.焊割金属时,用稀有气体作保护气
D.做菜时油锅不慎着火,迅速用锅盖盖灭
 6.做空气中氧气含量测定的实验装置如右图。下列有关说法正确的是
( )
6.做空气中氧气含量测定的实验装置如右图。下列有关说法正确的是
( )
A.选用红磷是因为反应可以耗尽O2,生成固态的P2O5
B.燃烧匙中的红磷可以换成硫或木炭
C.燃烧匙中的红磷越多,水位上升越高
D.本实验可以证明空气含有N2、O2、CO2和稀有气体
7.化学物质对人类有利有弊,对于碳的利弊评价不妥的是( )
A. 燃烧生成的二氧化碳会产生温室效应
B.燃烧生成的二氧化碳可以促进植物的光合作用
C.单质碳能将某些金属氧化物还原,可以用于制备某些金属
D.单质碳在密闭环境中燃烧可能产生有毒气体,因此,不能用炭炉取暖
8.某校化学课外活动小组在探究“二氧化碳真的在任何情况下都不支持燃烧吗”这一问题时,他们将燃着的镁条放入二氧化碳气体中 ,发现镁条仍在燃烧,大家十分兴奋。观察生成物,除白色物质外,还有黑色物质。于是,他们又将弯成螺旋状的细铁丝中插上一支燃着的火柴棒放入二氧化碳中,发现立即熄灭。对此,大家议论纷纷,各自发表看法如下。你认为正确的是( )
A.甲同学说,二氧化碳也能支持燃烧,所以它不能用于灭火
B.乙同学说,二氧化碳只能支持镁等少数活泼金属燃烧,因此,它不能用于活泼金属的灭火
C.丙同学写出了镁在二氧化碳中燃烧的化学方程式:Mg+CO2![]() MgO+C
MgO+C
D.丁同学说,这个反应属于置换反应
9.铁的应用在我国已有很久的历史。下列有关铁的叙述正确的是()
A. 一氧化碳在高温时可将氧化铁中的铁氧化出来
B.密封放在蒸馏水中的铁比空气中的铁生锈慢
C.同样大小的铁片和锌片分别放入同一种盐酸溶液中,铁片放出氢气快
D.人体中的铁元素主要存在于骨骼中
10.为创建国家级卫生城市,我市在学校、市场和居民小区等场所设置了废电池收集箱,其主要目的是为了 ( )
A.回收废电池的外壳材料
B.回收石墨电极
C.防止汞、镉、铅等重金属离子对土壤、水源的污染
D.防止废电池对大气造成光化学烟雾污染
11.下列有关溶液的认识中,错误的是 ( )
A.析出晶体后的溶液是该温度下的饱和溶液
B.在溶液中进行的化学反应,通常是比较快的
C.同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D.食物里的营养成分经消化变成溶液,容易被人体吸收
12.生活中的洗涤问题大都与化学知识有关。下列有关说法不正确的是 ( )
A.厨房洗涤剂可使餐具上的油污乳化
B.汽油可溶解衣服上的油渍
C.食醋可用来除去热水瓶中的水垢
D.自来水可溶解掉铁栅栏上的铁锈
13.测定生活中一些物质的pH,结果如下图。下列说法错误的是 ( )
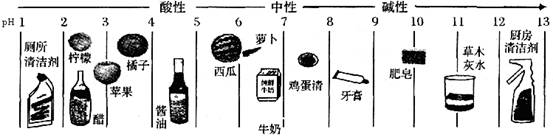
A.厕所清洁剂显酸性
B.胃酸过多的人不宜多吃柠檬
C.草木灰水能使紫色石蕊试液变红
D.肥皂水可以区别硬水和软水
14.酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是 ( )
A.施用熟石灰改良酸性土壤 B.服用含氢氧化铝的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液 D.用氢氧化钠溶液洗涤石油产品中残余硫酸
15.碳酸氢钠是生活中常见的盐,下列说法错误的是( )
A.发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B.干粉灭火器中含有碳酸氢钠,可用来扑灭油、气燃烧引起的火灾
C.碳酸氢钠和柠檬酸、水等混合可制成汽水
D.碳酸氢钠不能用作治疗胃酸过多的药剂
16.夏日里想随时喝到凉爽的饮料,可以自制化学“冰箱”,即把一种化学试剂放入一定量的水中,就可以形成低温小环境。这种试剂可以是下列物质中的 ( )
A.食盐 B.硝酸铵 C.蔗糖 D.熟石灰
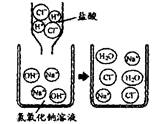 17.右图是盐酸滴入氢氧化钠溶掖中,有关粒子之间反应的示
17.右图是盐酸滴入氢氧化钠溶掖中,有关粒子之间反应的示
意图。下列说法错误的是 ( )
A.盐酸溶液中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
D.两种溶液混合时,钠离子与氯离子结合生成了氯化钠分子
18.实验室中的试剂常因与空气中的一些成分作用而发生变化,下列对试剂在空气中发生变 化的分析不正确的是()
A. 铁粉生锈与空气中的水蒸气和氧气有关
B.氢氧化钠潮解变质与空气中的水和二氧化碳有关
B. 氧化钙的变质与空气中的水和二氧化碳有关
D.浓盐酸变稀与空气中的水蒸气有关
 19.某校化学研究性学习小组,就施用化肥的利与弊为题进行小组辩论,甲方的观点是使用化肥有利,下列甲方观点不正确的是( )
19.某校化学研究性学习小组,就施用化肥的利与弊为题进行小组辩论,甲方的观点是使用化肥有利,下列甲方观点不正确的是( )
A.施用化肥可使农作物增加产量
B.施用化肥不会造成环境污染
C.化肥肥效快
D.复合化肥能给农作物提供几种营养元素
20.某同学在化学晚会上为大家现场作了一幅《镜湖灯影》的景色画:他在白纸上用干净的毛笔蘸取甲溶液“画上”一串灯影,再用另一支毛笔蘸取乙溶液在灯影周围“画上”一片湖水,将白纸挂在墙上,待晾干后,用装有丙溶液的喷雾器向白纸上喷洒。结果出现了“蓝色的湖面上倒映着红色的灯影”的画面。该同学所用的甲、乙、丙三种溶液可能是下列四项中的( )
甲 乙 丙
A.稀盐酸 氢氧化钠溶液 石蕊溶液
B.氢氧化钾溶液 稀盐酸 石蕊溶液
C.氯化钠溶液 硫酸钾溶液 硫酸钠溶液
D.石灰水 稀硫酸 氯化钠溶液
二、填空题及简答题 (本题包括9小题,共53分)
21.(5分)进入21世纪,全球拥有的化合物已超过2000万种,其中部分物质是由碳、氢、氧、钠中的某些元素组成的,请用上述元素,按要求各写出一种符合下列要求的物质的化学式:
⑴有还原性和用作气体燃料的氧化物 ;
⑵汽水中含有的一种酸 ;
⑶重要的化工原料,俗称苛性钠的碱 ;
⑷生活中常用作洗涤剂的纯碱 ;
⑸我国正在建设的“西气东输”工程中,将要输送的天然气的主要成分 。
22.(8分)小雨同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,过滤,请问:
⑴加明矾的作用是 。
⑵过滤后得到了澄清透明的水,他兴奋地宣布:我终于制得了纯水!对此你有无不同看法? 理由是 ,
若要制取纯水,还需采用的净化方法是 。
⑶若该湖水中除含泥沙外还含有细菌。某自来水厂用湖水制自来水,则生产流程为:湖水→ → → → →自来水。
⑷生活中区别硬水和软水最简便的方法可采用 。
23.(5分)化学与生活、生产密切相关。
⑴某食品的包装袋内,有一个装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分是生石灰,请勿食用”。生石灰起干燥作用时发生反应的化学方程式为 ,该反应的基本类型为 。
⑵现有三种铁矿石:①含Fe3O480%的磁铁矿石;②含Fe2O380%的赤铁矿石;③含FeS285%的黄铁矿石。若仅从铁的含量考虑,冶炼生铁的矿石应选用 (填序号)。在实际生产中,选用铁矿石还应综合考虑多种因素,如 等(至少答两种)。
24.(4分)下面是利用海水提取食盐的过程
 |
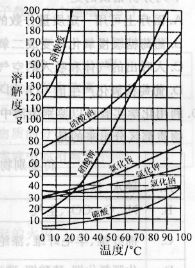 ⑴根据右边溶解度曲线推断:
⑴根据右边溶解度曲线推断:
上图中①是 池(填“蒸发”或“冷却”)。
⑵下列分析正确的是(填序号)
A.海水进入贮水池,氯化钠的质量分数基本不变;
B.在①的溶液中氯化钠的质量分数不改变;
C.结晶过程中氯化钠的溶解度一定减小;
D.析出晶体后的母液是食盐的不饱和溶液;
E.海洋中蕴藏着丰富的资源
25.(6分)请根据下列探究实验,回答问题。
⑴欲探究铁、银、铜的活泼性,最佳实验方案是 。
A.将铁、银分别加入到硫酸铜溶液中 B.将铁、铜分别加入到硝酸银溶液中
C.将铁、铜、银分别加入到盐酸溶液中 D.将银;铜分别加入到硫酸亚铁溶液中
⑵欲除去铜粉中的铁粉有多种方法,请列举其中三种。
① ;② ;
⑶欲确定金属铁、铜的硬度大小,正确的方法是:
26.(4分)溶液与人类生活息息相关,溶液的配制是日常生活和化学实验中常见的操作,下表是硫酸溶液和氨水的密度与其溶质质量分数对照表(20℃)
| 溶液中溶质的质量分数/% | 4 | 12 | 16 | 24 | 28 |
| 硫酸溶液的密度/g/cm3 | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/g/cm3 | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
⑴氨水的密度与溶液中溶质质量分数的关系是 ;
⑵向10g28%的硫酸溶液中加水60g,摇匀,所得溶液的体积约是 mL(保留一位小数)
27.(6分)被誉为”江南小三峡”的南京胭脂河是明代初年开凿的一条人工运河。卤其“石有胭脂色”而得名。胭脂河沿岸的那些红色石块的成分是什么?某研究性学习小组取一小块这种红色石块A,粉碎后对其成分进行实验探究,实验记录如下图所示。

请你根据实验推断:组成A的元素有
B中肯定含有的溶质是 (写化学式)。
写出实验中有关反应的化学方程式:②
⑤
28.(7分)维生素C又名抗坏血酸,易溶于水,已被氧化,能与碘反应。人
体缺乏维生素C可能引发多种疾病。某研究性学习小组对它研究如下:
⑴猜想:维生素C可能具有酸性?
⑵实验方案:
提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、稀盐酸、氢氧化钠溶液、氯化钡溶液、pH试纸。
根据以上试剂,请你帮助他们设计出两种实验方案,并写出实验现象:
| 实 验 内 容 | 实 验 现 象 |
| 方案Ⅰ : |
|
| 方案Ⅱ: |
|
⑶结论:维生素C具有酸性。根据维生素C的性质,判断下列物质中能与维生素C反应的是( )。
A.金属镁 B.食盐 C.氢氧化钠 D.硫酸铜
29.(8分)化学反应往往伴随着发生一些现象,但CO2与NaOH溶液的反应没有明
显的现象发生。为了通过一些现象说明CO2和NaOH发生了反应,某班同
学分两组做了如下探究实验:
 ⑴第一组同学把一支收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中(如右图所示),看到试管内液面上升。这种现象是因为试管内外产生( )。
⑴第一组同学把一支收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中(如右图所示),看到试管内液面上升。这种现象是因为试管内外产生( )。
A.温度差 B.重力差 C.压强差 D.浮力差
⑵第二组同学从中得到启发,也设计了如下实验装置进行探究:

你认为能达到实验设计要求的是(填序号) 。
⑶同学们经过分析讨论,认为第一组的实验中产生液面上升这种现象的原因可能有两种,一种是因为CO2与NaOH溶液反应,消耗了CO2;你认为另一种是
⑷为了进一步证实CO2与NaOH溶液已经发生了反应,请你设计一个实验进行验证(要求写出实验步骤、现象和结论)。
三、计算题(本题包括1小题,共7分)
30.某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符。随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠。准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应,其反应式:Na2CO3+CaCl2=2NaCl+CaCO3↓。将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体10克。
⑴计算10.9克样品中纯碱的质量。
⑵计算样品中含纯碱的质量分数。
⑶根据检验结果,此纯碱 (选填“可以”或“不可以”)列入“诚信商品”。

答案:一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | B | C | D | A | A | D | B | B | C | C | D | C | C | D | B | D | D | B | A |
二、填空题及简答题
21. ⑴CO ⑵H2CO3 ⑶NaOH ⑷Na2CO3 ⑸CH4
22.⑴对杂质吸附,使杂质沉降
⑵他没有制得纯水,他只是除去了不溶性杂质,还有可溶性杂质,如钙镁的化合物等未除去; 蒸馏
⑶沉淀 过滤 吸附 消毒
⑷加肥皂水看泡沫多少情况
23.⑴CaO + H2O =Ca(OH)2;化合反应;
⑵①;价格、环境保护、冶炼技术、综合应用等
24. (1)蒸发;(2)AE
25. ⑴A ⑵略 ⑶略
26.(1)氨水的质量分数越大,溶液的密度越小;(2)68.6
27. Fe、C、O ;FeCl3 ;CO2 + Ca(OH)2 =CaCO3 ↓+ H2O ;Fe +CuSO4 == FeSO4 + Cu
28. (2) ①将维生素C片溶于蒸馏水配成溶液,向其中滴加石蕊试液;溶液变红色。
②将维生素C片溶于蒸馏水配成溶液,用玻璃棒蘸取溶液滴在pH试纸上,跟比色卡比较;pH试纸变红色或pH小于7。
③ 将维生素C片溶于蒸馏水配成溶液,把维生素C的溶液逐滴滴入氢氧化钠的酚酞溶液;红色消失。
(3)A、C
29. (1)C (2)A、B、C (3)CO2溶于水,消耗了CO2
或CO2与水反应消耗了CO2
(4)取上述实验后的溶液,向其中加入盐酸溶液,若有气泡产生,说明
NaOH与CO2发生了化学反应
30. 答案:解:设样品中含纯碱的质量为ⅹ
(1) Na2CO3+CaCl2 == 2NaCl+CaCO3↓
106 100
ⅹ 10克
106:100 = ⅹ:10克
ⅹ=10.6 克
样品中纯碱的质量为10.6 克。
(2)纯碱的质量分数=10.6 克 ÷10.9克=97.25 %
(3)可以