第九单元测试题
可能用到的相对原子质量:H:1 C:12 N:14 O: 16 P:31 S:32 Cl:35.5 K:39 I:127
一、选择题(每小题只有一个正确选项)
1、熟石灰在农业上常用来改良酸性土壤,当施用熟石灰时,同时不适宜施用的化肥是( )
A 硝酸钾 B 氯化铵 C 尿素 D 过磷酸钙
2、下列对于废弃塑料制品的处理方法中,最为恰当的是( )
A 将废弃物焚烧 B 将废弃物倾倒在海洋中
C 将废弃物应用化学方法加工成防水涂料或汽油
D 将废弃物切成碎片,混在垃圾里填埋于土壤中
3、绿色化学是“预防污染”的根本手段。下列措施中属于绿色化学的是( )
A 处理废弃物 B 治理污染点 C 减少有毒物 D 杜绝污染源
4、目前科学家认为理想的制氢方法是寻找合适的光分解催化剂,使水在太阳光照射下分解产生氢气。下列有关说法不正确的是( )
A 该催化剂能加快水在太阳光照射下分解的速率 B 该制氢的方法是将光能转化成化学能
C 该方法是将化学能转化成光能 D 该催化剂在此过程前后,质量与化学性质不变
![]() 5、城市生活用水是经过自来水厂净化处理过的,其过程可表示为:取水
5、城市生活用水是经过自来水厂净化处理过的,其过程可表示为:取水
沉降 过滤 吸附 消毒 配水,下列属于化学变化的是( )
A 取水 B 过滤 C 吸附 D 消毒
6、下列物质中,与NaOH溶液和稀盐酸都能反应,并且都生成气体的是( )
A NH4Cl B (NH4)2CO3 C NH4NO3 D Na2 CO3
7、生产生活中排放到空气中的下列气体,能导致雨水的pH小于7的是( )
①CO ②SO2 ③NO2 ④CO2 ⑤H2S ⑥NH3(氨气)
A 只有②④⑤ B 只有①②③④ C 只有③④⑤⑥ D 只有②③④⑤
8、我国三峡工程所提供的清洁、价廉、强劲、可再生的水电,相当于每年燃烧3000万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制( )
①温室效应 ②白色污染 ③二氧化硫污染 ④ 烟尘污染
A ①③ B ②③④ C ①②③④ D ①③④
9、关于保护水资源的叙述正确的是( )
A 化肥是有用的植物养分,流入河水中不会污染水
B 农药可杀灭病虫害,流入河中可起杀菌作用而无害
C 农药、化肥随雨水流入河中,会使河水受到污染 D 生活污水流入河中不会使河水受到污染
10、下列各项中,最容易受酸雨腐蚀的是( )
A 铜制塑像 B 大理石雕像 C 玻璃钢雨罩 D 塑料门窗
11、冬天室内用煤炉取暖,如果烟囱排气不畅,可能会发生煤气中毒,造成煤气中毒的气体主要是下列的( )
A CO2 B CH4 C SO2 D CO
12、水中某些植物营养元素含量过高,可导致水面上藻类疯长,水质恶化,发生“赤潮”“水华”现象,下列导致藻类生长过快的是( )
A H B C C O D P
13、下列情况:①煤的燃烧 ②工业废气的任意排放 ③燃放鞭炮 ④用汽油为燃料的汽车尾气的排放 ⑤用氢气为燃料的新型汽车排放的尾气,会引起空气污染的是( )
A ①④⑤ B ①②③ C ①②③④ D ①②③④⑤
14、以下不属于高分子材料的是( )
A 塑料 B 合成纤维 C 合成橡胶 D 合金
15、下列化肥属于复合肥料的是( )
A KNO3 B Ca(H2PO4) 2 C K2CO3 D NH4NO3
16、被誉为“春果第一枝”的大樱桃已成为烟台农业经济的一个亮点,为了预防大樱桃在成熟期发生裂果现象,果农常施用一种钾肥,这种钾肥的水溶液能跟氯化钡溶液反应生成不溶于稀硝酸的白色沉淀,该钾肥为( )
A KNO3 B K2CO3 C K2SO4 D KCl
17、今年,媒体不断宣传预防肝炎病的传染,从防疫和环保考虑你认为下列“一次性餐具”最具有发展前景的是( )
A 瓷器餐具 B 淀粉餐具 C 塑料餐具 D 银质餐具
18、 某工厂排放的废气中CO2、SO2均超标,技术人员采用下列治理废气方法中正确的是( )
A 用NaCl溶液吸收 B 用NaOH溶液吸收 C 用浓HCl溶液吸收 D 用浓H2SO4溶液吸收
19、以羟基磷酸钙[Ca5(OH)(PO4) 3]为原料生产的陶瓷,能够制造人造骨、人造关节及人造假牙。羟基磷酸钙中磷元素的化合价为( )
A +5 B +4 C +3 D -3
20、寿光市被称为“蔬菜之乡”。某菜农原计划每亩施用硫酸铵[(NH4)2SO4]13.2kg,后在科技人员的指导下,改施用尿素[CO(NH2) 2],如果要达到同样的施肥效果,则每亩菜田需施尿素为( )
A 3kg B 6kg C 6.6kg D 13.2kg
二、填空题
1、 有下列四种物质:玻璃、有机玻璃、玻璃钢、不锈钢。其中属于硅酸盐材料的是 ;属于金属材料的是 ;属于塑料的是 ;属于复合材料的是 。
2、雨水的pH一般小于 时,该降雨为酸雨。
3、氢气是未来的理想能源,其优点是 、 、
。
4、玻璃的原料是石英砂、纯碱、石灰石,写出制玻璃的有关反应
, 。
5、为减少含硫煤燃烧对大气的污染,适宜在煤中加入的物质是 和 。
6、根据2002年《化学世界》期刊介绍,最近我国著名化学家徐辉碧教授根据众多实验事实提出硒(元素符号Se)与艾滋病的发生和发展有关。硒的一种化合物K2SeO4中硒元素的化合价为 。已知K2SeO4的名称叫 。
7、配好的波尔多液装在铁桶内,为什么会降低药效?
8、2004年初,高致病性禽流感袭击我国很多是区,据了解,很多消毒剂对禽流感病毒有抑制杀灭作用。酚类消毒剂中的煤酚皂就是其中的一种消毒剂,煤酚皂的主要成分为甲基苯酚(化学式为C7H8O),请根据甲基苯酚化学式计算:
(1) 甲基苯酚的相对分子质量为
(2) 甲基苯酚中碳元素、氢元素、氧元素的质量比为
(3) g甲基苯酚中含6g氢元素。
9、用KCl和KH2PO4固体配制钾、磷元素、水的质量比为78:31:1000的植物生长营养液,所耗用的KCl和KH2PO4的质量比为
10、北京6月2日讯,国家环保总局发布的《2004年中国环境状况公报》中指出下列内容:①酸雨污染呈加重趋势 ②山西的临汾、阳泉、大同等三城市空气污染指数列全国113所环保城市前三位 ③七大水系中海河水系质量最差 ④我国城市人口占全国人口逾40%.由此根据所学知识回答:
(1) 造成酸雨污染呈加重趋势的原因是(写一种)
(2) 山西污染指数中首位是可吸入颗粒,这与所处地区自然资源与工业生产直接相关。你认为造成空气中可吸入颗粒增多的原因是(写一种)
(3) 取海河水系某支流河水分析,其主要污染物有较多悬浮物,河水呈碱性,水中含较多CO32-和有机物质(淀粉、蛋白质、洗涤剂等),还有大量病原体(如细菌、寄生虫等)
① 用pH试纸测定河水酸碱度的方法是
② 要除去水中的细小颗粒,可在水中加入 (填物质名称)作净水剂,然后静置处理。
③ 要除去水中较多的CO32-离子,并使水体呈中性,可加入的物质是(写一种)
④ 水体中有机物增加,水体溶解氧的能力会 (选填“增强”“减弱”或“不变”)
⑤ 为有效消除水体中的病原体,可选用下列物质中的 (选填序号)。
A 二氧化碳 B 漂白粉 C 氧气 D 石子和细砂
 11、植物的生长需要营养元素,下图表示了土壤的pH和植物吸收这些元素的关系。栅栏越宽,营养元素的吸收率越高。
11、植物的生长需要营养元素,下图表示了土壤的pH和植物吸收这些元素的关系。栅栏越宽,营养元素的吸收率越高。
(1)当pH=4时,土壤显 性,在这种土壤中植物往往不能正常地生长,这是因为
(2)如果施用一种能使作物根系发达,耐寒耐旱的肥料,当土壤的pH在 时,植物的吸收率较高。
(3)如果施用由硝酸钾和磷酸二氢铵组成的复合肥料,为了使营养元素能最大限度地被吸收,土壤的pH应该控制在
三、实验题
1、白色固体碳酸氢铵(NH4HCO3)加热分解生成三种物质。请选用下图提供的实验装置,根据以下要求,填写空白。
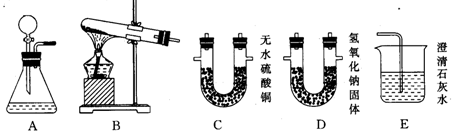 |
(1)加热分解碳酸氢铵,白色固体应加入装置 (填序号)中。
(2)分解产物之一是水,为验证它,应选择装置 (填序号)进行检验,所观察到的现象是 。
(3)产物之二是一种气体,通过装置E时,澄清的石灰水变浑浊,则该产物是 (假设已除去另两种产物)。
(4)产物之三是氨气(NH3),它能使紫色石蕊试液变蓝,则氨气的水溶液显 性(填“酸”、“中”或“碱”)
(5)碳酸氢铵加热分解的化学方程式为 。
2、 硝土中含硝酸镁、硝酸钙、氯化钠等物质,草木灰的主要成分是碳酸钾,民间曾用硝土和草木灰作原料制取硝酸钾。其主要生产流程为:
(1) 写出步骤①中生成MgCO3沉淀的化学方程式:
反应类型
(2)  步骤④中滤液可重复使用的理由是
步骤④中滤液可重复使用的理由是
(3) 解释生产流程中用蒸发结晶得到NaCl晶体,而用冷却结晶得到KNO3晶体的原因:
四、计算题
| 国内首创 优质碳酸氢铵 NH4HCO3 含氮量全球最高(19.8%) |
1、 小强同学在公共场所围墙上看到一则化肥广告。
(1)回校后,小强通过计算氮的质量分数发现该广告是虚假广告。请你写出小强的计算过程和判断依据。
(2)小强认为此广告会坑害农民,向有关部门反映,技术监督局对该产品取样品分析,发现其氮元素质量分数仅为12.0%,则该产品中碳酸氢铵的质量分数为多少?
2、二氧化硫是大气污染物之一,我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示:
| 浓度限值(mg/m3) |
| 一级标准 二级标准 三级标准 0.15 0.50 0.70 |
为测定某地空气中二氧化硫的含量,某中学环保小组按下图所示的实验装置进行如下实验:向试管中加入一定量的含碘(I2)1.27mg的碘溶液,再加入2-3滴淀粉溶液(淀粉遇I2变蓝色),通过抽气装置抽气,使空气由导气管进入试管与碘溶液充分接触,当溶液由蓝色变为无色时,恰好完全反应。反应的化学方程式是:SO2+I2+2H2O=H2SO4+2HI。实验过程中进入试管内的空气的总体积为1000L.请通过计算判断出此空气中二氧化硫的浓度级别。
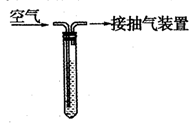 |
参考答案
一、1 B 2 C 3 D 4 C 5 D 6 B 7 D 8 D 9 C 10 B 11 D 12 D 13 C 14 D 15 A 16 C 17 B 18 B 19 A 20 B
二、1、玻璃 不锈钢 有机玻璃 玻璃钢
2、5.6 3、略 4、略 5、石灰石和生石灰 6、+6 硒酸钾 7、略
8、(1)108 (2)21:2:4 (3)81 9、149:272(74.5:136)
10、(1)硫的氧化物的排放增多等 (2)化石燃料的燃烧等
(3)①用玻璃棒蘸取河水滴在pH试纸上,然后与标准比色卡对照
②明矾 ③盐酸 ④减弱 ⑤B
11、(1)酸 土壤酸性较强,氮、磷、钾吸收率低
(2)5.7~7(pH下限允许误差±0.2) (3)6~7
三、1、(1)B (2)C 固体由白色变为蓝色 (3)CO2 (4)碱
|
(5)NH4HNO3=== NH3↑+H2O+CO2↑
2、(1)Mg(NO3) 2+K2CO3=MgCO3↓+2KNO3 复分解反应
(2)滤液中含有较多的KNO3(或重复利用滤液中的KNO3,节约原料,提高原料的利用率)
(3)NaCl的溶解度受温度变化的影响较小,KNO3的溶解度受温度变化的影响较大
四、1、略 2、67.8%
2、 解:设参加反应的二氧化硫的质量为x
SO2 + I2 + 2H2O = H2SO4 + 2HI
64 254
x 1.27mg
64:254=x:1.27mg
x=0.32mg
空气中二氧化硫的浓度为0.32mg/1000mL=0.32mg/m3
由于0.15mg/ m3<0.32mg/m3<0.5 mg/m3
所以空气中二氧化硫的浓度级别为二级。