初三化学模拟试卷
可能用到的相对原子质量:
H:1 Na:23 O:16 S:32 Cl:35.5 Ca:40 K:39
第Ⅰ卷(选择题 40分)
一、 选择题(本题共20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1、 下列词汇中,与相关物质的颜色并无联系的是:
A.白色污染 B.赤潮现象 C.绿色食品 D.棕色烟雾
2、清新的空气,蔚蓝的天空,这曾经是我们的家园,要保护好我们美丽的家园,就要控制污染物的排放。下列气体组中的各种气体都属于空气污染物的是:
A.CH4,CO2,H2 B.CO2,HCl,N2
C.SO2,CO,NO2 D.HCl,N2,O2
3、常温下,当碘与镁化合时,速度很慢,若滴几滴水,则剧烈反应生成碘化镁,还形成一股美丽的紫色烟雾,在此反应中水的作用是:
A.溶剂 B.催化剂 C.氧化剂 D.还原剂
4、为了防止患甲状腺肿大病,市售食盐中常添加一定量的
A.葡萄糖 B.碘酸钾 C.碳酸钠 D.氯化钾
5、用“王水”(浓盐酸与浓硝酸的混合物)溶解黄金后得到一种物质:HAuCl4(四氯合金酸),其中金元素的化合价为:
A.+1 B.+2 C.+3 D.+4
6、利用家中杯子、瓶子、碗、筷、匙、饮料瓶、吸管以及食盐、冰糖和水等可以进行的操作练习有:①固体药品的取用②液体倾倒③排水集气法④过滤
A.①②④ B.②③④ C.①③④ D.①②③
7、欲使配制的水溶液中含有大量Cl-、Mg2+、NO3-、K+等离子,应使用的一组试剂是
A.Mg(OH)2、KNO3、KCl B.KOH、MgSO4、Mg(OH)2
C.HNO3、Mg(OH)2、KCl D.MgCO3、KCl、Na2CO3
8、下列化学反应能说明水具有的化学性质的是
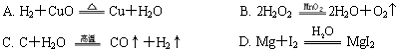
9、实验室制取二氧化碳应选用的一组药品是
A.石灰石、稀硫酸 B.石灰石、浓盐酸
C.石灰石、稀盐酸 D.碳酸钠、稀盐酸
10、某花圃所种的花卉缺乏氮和钾元素,如果只可施用一种化肥,应施的是
A.NH4NO3 B.KNO3
C.KCl D.Ca(H2PO4)2
11、"垃圾"是放错了位置的资源,应该分类回收。生活中放弃的铁锅、铝质易拉罐、铜导线等可以归一类加以回收,它们属于
A.有机物 B.金属或合金
C.氧化物 D.矿物
12、生活中的下列现象不能说明气体溶解度随温度升高而减小的是
A.烧开水时,沸腾前有气泡冒出
B.阳光充足时,盛满水的鱼缸上有小气泡
C.启开啤酒瓶盖,有大量气泡沫溢出
D.夏季黄昏时,池塘里的鱼浮出水面
13、“钻石恒久远,一颗永流传”这句广告词被美国《广告时代》评为20世纪的经典广告之一,该广告词能体现的钻石的性质是
A.硬度大 B.不能导电 C.化学性质稳定 D.熔点低
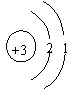 14、月球土壤含有大量氦3原子,它可能成为未来核能的重要原料。氦3原子核内有2个质子和1个中子。氦3原子结构示意图是
14、月球土壤含有大量氦3原子,它可能成为未来核能的重要原料。氦3原子核内有2个质子和1个中子。氦3原子结构示意图是
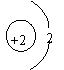

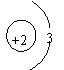
| |
15、下列各组中的物质相互转化时,均能通过一步反应实现的是
![]()
![]() A.KCl KNO3
B.C CO2
A.KCl KNO3
B.C CO2
![]()
![]() C.Cu(OH)2 Cu D.KOH K2SO4
C.Cu(OH)2 Cu D.KOH K2SO4
16、鱼味道鲜美,但剖鱼时弄破鱼胆,胆汁沾在鱼肉上,便有苦味,产生苦味的是胆汁酸,其pH约为6,且难溶于水。则在沾有胆汁的地方涂上下列物质可能消除苦味的是
A.自来水 B.食醋 C.食盐水 D.纯碱溶液
17、下列各组物质中,分别加入稀盐酸后,会出现两种不同现象的是
A.Na2CO3和K2CO3 B.AgCl和BaSO4
C.Ba(NO3)2溶液和NaOH溶液 D.Fe和Zn
18、已知完全中和一定量的某氢氧化钾,需100克3.65%的盐酸溶液,若改用100克3.65%的硫酸溶液,则反应后溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
19、用水作试剂,不可能区分开来的一组物质是
A.生石灰,食盐,烧碱 B.汽油,酒精,浓硫酸
C.无水硫酸铜,碳酸钙,碳酸钠 D.氯化钾,硝酸钠,硫酸钾
20、在CuCl2和AlCl3和混合溶液中,加入过量的锌粉,充分反应后过滤,留在滤纸上的物质是
A.Cu B.Cu和Al C.Zn和Cu D.Cu,Al和Zn
第Ⅱ卷(非选择题 60分)
二、填空题(本题共8小题,共33分)
21、(4分)用化学符号表示下列各小题:
(1)2个氮原子 ,(2)3个氢氧根离子 ,
(3)氧化镁中镁元素显+2价 ,(4)
22、(3分)根据“物质的组成和结构决定物质性质”的观点,简要说明下列各组物质性质相似或差异的原因。
(1) 钢的性能比生铁优越,使用范围远超过生铁。
(2) 盐酸和硫酸都是酸,但前者不能跟硝酸钡溶液反应,而后者却能跟硝酸钡溶液反应。
(3) 氢氧化钠和氢氧化钙的溶液都能使无色酚酞溶液变红。
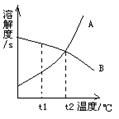
23、(2分)右图是A、B两种物质的溶解度曲线,试回答下列问题:
|
(填“<”“>”或“=”)
(2)A、B两种物质的溶液接近饱和时,采
用增加溶质、蒸发溶剂、降低温度的方法可以
达到饱和的是 物质的溶液。
24、(8分)请按下列要求写出下列反应的化学方程式:
氢气球遇火发生爆炸: ;
用生石灰吸收空气中水分: ;
“曾青得铁则化为铜”: ;
泡沫灭火器原理
(主要成分为HCl和Na2CO3): ;
25、(4分)2003年4月,我国登山运动员再次登上世界屋脊——珠穆朗玛峰。登山运动员山时所带的能源是氢化钙(CaH2),它与水发生剧烈反应生成氢气和氢氧化钙,该反应的化学方程式 。当登山运动员需要热量时,将上述反应中生成的氢气点燃,该过程中实现了能量转化,即 能转化成 能。
26、(3分)茶叶、肉松、膨化食品等常采用真空充气包装,即将食品装入包装袋,抽出包装袋内空气,再充入防止食品变质的气体,然后封口。真空充气包装袋能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形。
提出问题:充入食品包装袋中的气体是什么?
猜想与验证:可能是N2。实验初步验证的方法及现象:
。
充入的气体还可能是:① ;② ……
27、(4分)有下列四种物质:①无水硫酸铜②氢氧化钠溶液③稀硫酸④硝酸银溶液
根据题意把正确答案的序号填入空格内:
(1)除去CO中混有的少量CO2可以用 ;
(2)鉴别NaCl溶液和KNO3溶液可以用 ;
(3)证明H2中含有水蒸气可以用 ;
(4)研究Zn的Cu金属活动性可以用 。
28、(5分)有一包白色粉末,可能由碳酸钡、碳酸钠、硫酸钠、硫酸铜和氯化钡中的一种或几种组成。为了确定它的组成,某化学小组同学进行了如下探究活动:
提出假设:白色粉末由上述五种物质组成。
实验探究:
步骤1:取少量白色粉末,加足量水溶解后过滤,得到白色沉淀和无色滤液。
步骤2:取少量由步骤1得到的白色沉淀,加入足量稀硝酸后,部分沉淀溶解,并有无色气体产生。
获得结论:
(1)原白色粉末中一定没有 (写化学式),说明假设不成立;
(2)步骤1得到的沉淀是 (写化学式);
(4) 白色粉末的组成可能是(写化学式):
三、实验题(本题共2小题,共15分。)
29、某同学设计了如下一组实验,取四朵用石蕊试液染成的紫色的干燥纸花,分别按下图进行实验,回答下列问题:(6分)
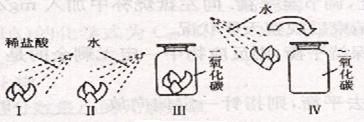
(1)观察到纸花的颜色变化是
I纸花变红Ⅱ ,Ⅲ纸花不变色,Ⅳ 。
(2)该同学进行的Ⅰ、Ⅱ两项实验,说明了什么?
。
(3)该同学进行四组对比实验的目的是什么?(用文字叙述)
。
(4)写出实验Ⅳ中发生的化学方程式 。
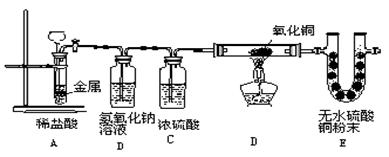
30、(9分)如图,将一块金属放在盛稀盐酸的反应器中,反应发生一定时间后在装置D处加热,稍后可见装置E中的白色无水硫酸铜粉末变蓝。
|
试回答下列问题:
(1)E中白色的无水硫酸铜变蓝,说明D中反应物有 ,写出E中变化的化学方程式 。
(2)从E中的变化证明装置A一定有 生成。
(3)写出装置D中发生反应的化学方程式 。
(4)A中反应发生的前提是 。
(5)B装置的作用是 C装置的作用是 。
四、计算题(本题共2小题,共12分)
31、(6分)有一种石灰石样品,其中含有的杂质是二氧化硅(二氧化硅是一种不溶于水,不与盐酸反应,耐高温的固体)。某学生想测定该样品的纯度,他取用2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体质量见下表。问:
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.315g |
| 第二次加入5g | 0.63 g |
| 第三次加入5g | 0.3 g |
| 第四次加入5g | 0.3 g |
(1) 2g石灰石样品中,有杂质多少克?
(2) 石灰石样品的纯度是多少?
(3) 100kg这种纯度的石灰石煅烧后,可得到固体多少千克?
32、(6分)将5克固体氢氧化钠完全溶解在50克溶质质量分数为12%的氢氧化钠溶液中。
(1) 求所得溶液的溶质质量分数;
为测算某盐酸的溶质质量分数,现取10克上述所得的氢氧化钠溶液与18.25克此盐酸混合,且恰好完全反应。求此盐酸的溶质质量分数。
初三化学模拟试卷答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | B | B | C | D | C | C | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | C | D | D | D | D | A | D | C |
|
21、(1)2N (2)3OH- (3)MgO (4)Cl-
22、 (1)钢与铁的含碳量不同,钢的含碳量低,性能好
(2)两者的构成离子不同,Cl-不与Ba(NO3)2反应,SO42-可与Ba(NO3)2生成沉淀
(3)两者都有能使无色酚酞变红的OH- 。
23、(1)< (2)A
24、 2H2+O2![]() 2H2O
2H2O
CaO+H2O=Ca(OH)2
Fe+CuSO4=FeSO4+Cu
2HCl+Na2CO3=2NaCl+H2O+CO2↑
25、 CaH2+2H2O=Ca(OH)2+2H2↑ 化学 热
26、将气体收集到一塑料袋内,用燃着的木条放在袋口,轻轻挤压袋子,气体能使燃着的木条熄灭。另取一袋此气体把它挤入澄清石灰水,未见浑浊,则证明是N2。
①CO2 ②N2 、、 CO2混合气体
27、(1)②(2)④(3)①(4)③
28、 (1)CuSO4
(2)BaCO3、、BaSO4
(3) ①BaCO3、Na2SO4、BaCl2
②Na2CO3、、Na2SO4、BaCl2
③BaCO3、Na2SO4、BaCl2、Na2CO3
三、实验题
29、 (1)纸花无变化 纸花变红
(2)稀盐酸能使紫色石蕊变红,水不能
(3)得出结论:能使紫色石蕊变红的是酸,二氧化碳溶于水可生成酸,而水与二氧化碳不能使紫色石蕊变红
(4) CO2+H2O=H2CO3
30、(1)H2 CuSO4+5H2O=CuSO4·5H2O
(2)H2
(3)H2+CuO![]() Cu+H2O
Cu+H2O
(4)要在金属活动性顺序表中排在氢前的金属才可以发生。
(5)吸收可能出现的HCl气体 吸收水份以防止对E的检验产生干扰。
四、计算题
31、 (1)有杂质0.3g
(2)石灰石的纯度是:[(2g—0.3g):2g]×100%
=85%
(3)设可生成氧化钙的质量为X:
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 56
100kg×85% X
100:56=100kg×85% :X
X=47.6kg
答:(略)
32、 (1)所得溶液的溶质质量分数为:
[(5g+50g×12%):(5g+50g)]×100%
=20%
(2)设此盐酸的溶质质量分数为X:
HCl + NaOH= NaCl + H2O
36.5 40
18.25gX 10g×20%
36.5:40 = (18.25gX) : (10g×20%)
X = 10%
答:(略)
(2)