初三化学上期综合练习及答案(四)
一、选择题
1.硫酸铁的化学式是 ( )
A.Fe2(SO4)3 B.FeSO4 C.FeS D.FeCO3
2.下列物质属于纯净物的是 ( )
A.铁锈 B.生铁 C.磁铁矿石 D.四氧化三铁
3.做细铁丝在氧气中燃烧的实验时,盛放氧气的集气瓶中,总是预先装少量水或在瓶底铺一层细沙,其目的是 ( )
A.为了使燃烧更剧烈 B.用来吸收生成的物质
C.为了防止溅落的熔化物炸裂瓶底 D.用来吸收反应放出的热量
4.铁生锈这种变化属于 ( )
A.剧烈的氧化反应 B.物理变化
C.缓慢的氧化反应 D.复分解反应
5.下列化合物中,铁的质量分数最高的是 ( )
A.Fe3O4 B.Fe2O3 C.FeO D.FeS
6.某学生用量筒量取液体,将量筒平放且面对刻度平视测量。初次视线与量筒内凹液面的最低处保持水平,读数为20 毫升。倒出部分液体后,俯视凹液面的最低处,读数为5 毫升,则该学生实际倒出液体的体积 ( )
A.大于15 毫升 B. 小于15 毫升 C.等于15 毫升 D.无法确定
7.由C、H两种元素组成的化合物叫烃,碳原子数在4及以下的烃在常温常压下通常为气体,常温常压时烃C2H4和另一种烃组成的混合气体中碳元素的质量分数为87%,则混入的烃可能是 ( )
A.CH4 B.C2H2 C.C2H6 D.C8H8
8.两种化合物AB和DB2,若A元素的化合价与H2O中O的化合价绝对值相同,则D的化合价为 ( )
A.+4 B.+2 C.-2 D.-3
9.用铁矿石(主要成分是Fe2O3)炼铁,一氧化碳是 ( )
A.溶剂 B.催化剂 C.氧化剂 D.还原剂
10.两包粉末,一是铁粉,二是氧化铜粉,快速将它们鉴别出来的方法是 ( )
A.观察颜色,加以鉴别 B.分别加水溶解,加以鉴别
C.用磁铁吸引,加以鉴别 D.装入试管中分别加热,再分别通入H2观察现象,加以鉴别
11.下列叙述属于铁的化学性质的是 ( )
A.铁容易传热导电 B.铁溶于稀硫酸 C.纯铁是银白色的金属 D.铁具有良好的延展性
12.关于铁及其合金的说法,错误的是 ( )
A.纯铁是银白色的金属 B.铁、锰、铬属于黑色金属
C.铁与盐酸反应生成氢气和氯化铁 D.生铁和钢都是铁的合金
13.下列说法正确的是 ( )
A.合金必须是由两种金属熔合而成,具有金属特性
B.(因为生铁是含碳质量分数在2%~4.3%之间的铁合金,所以生铁中含铁和碳两种金属
C.铁元素在地壳中的含量位于第三 D.碳素钢中含碳量越高,钢的硬度越大
14.下列物质及其主要成分表示正确的是 ( )
A.磁铁矿:主要成分是Fe2O3 B.赤铁矿:主要成分是Fe2O3
C.菱铁矿:主要成分是FeO D.铁锈:主要成分是Fe3O4
15.下列反应中属于置换反应的是 ( )
A.CuO +2HCl ==== CuCl2+H2O B.3Fe+2O2![]() Fe3O4
Fe3O4
C.Fe+CuSO4 ==== FeSO4+Cu D.Fe2O3+3H2SO4 ==== Fe2(SO4)3+3H2O
16.打雷放电时,空气中有极少量氧气会转化成臭氧(3O2 = 2O3),下列有关说法中正确的是( )
A.该变化是物理变化 B.O2与O3都是单质 C.O2与O3是不同的物质 D.O2与O3的性质完全相同
17.在大气层中,因CO2的含量不断增加而引起“温室效应”,造成大气中CO2含量增加的主要原因是 ( )
A.由于动植物呼吸作用增加 B.由实验室逸出的CO2增加
C.由于森林绿化面积迅速递减,使得自然界吸收CO2的能力降低 D.由于大量燃烧矿物燃料
18. 飘尘是物质燃烧时产生的粒状飘浮物,颗粒很小,不易沉降。它与空气中的SO2、O2接触时,SO2会部分转化为SO3,使空气的酸度增加。飘尘所起的作用可能是 ( )
A.氧化剂 B.还原剂 C.催化剂 D.吸附剂
19.在一定温度下将10克某物质溶于50克水中,则此时该物质的溶解度是 ( )
A.5克 B.10克 C.20克 D.无法计算
20.下列关于溶液的说法,正确的是 ( )
A.饱和石灰水一定是浓溶液 B.无色的液体一定是溶液
C.溶液一定是均一、稳定的 D.溶液一定是固体溶于水形成的
21.t℃时在一瓶氯化钠的饱和溶液中,再加入少量氯化钠晶体,下列说法正确的是 ( )
A.晶体质量减少 B.溶质质量分数增大 C.晶体质量不变 D.溶质的溶解度发生变化
22.下列说法正确的是 ( )
A.凡是溶液都是无色、透明、澄清的 B.均一、稳定、澄清的液体一定是溶液
C.在溶液中,各部分的物理性质及化学性质都相同
D.烧杯中盛有100克某浓度的庶糖水,从中倒出50克后,烧杯中剩余溶液的浓度减小
23.在t℃时,把10克A物质的饱和溶液蒸干后得到2克A物质的晶体,则在t℃时,A物质的溶解度为 ( )
A.20克 B.25克 C.5克 D.2克
24.饱和溶液一定是 ( )
A.浓溶液 B.不能再溶解任何其它物质的溶液C.稀溶液 D.同种溶质在该温度下最浓的溶液
25.将不饱和溶液转变为饱和溶液,最可靠的方法是 ( )
A.升高温度 B.降低温度 C.加入溶质 D.倒出溶剂
26.托盘天平的两托盘上各放一质量相同的烧杯,烧杯中都盛有等质量等浓度的稀硫酸,天平保持平衡状态,现向左右两边烧杯中分别加入等质量的Mg和Fe,反应完毕后,天平仍保持平衡,则下列结论正确的是( )
A、两烧杯中放出了相同质量的H2 B、Fe和Mg都已完全反应
C、两烧杯中硫酸均有剩余 D、Mg一定有剩余,Fe可能有剩余
27.t℃时的硝酸钾溶液200克,蒸发20克水后析出晶体8克;又蒸发20克水后析出晶体12克。则t℃时,硝酸钾的溶解度是 ( )
A.60克 B.50克 C.40克 D.100克
二、填空题
28.铁与稀硫酸反应,溶液的颜色由________________色变成_______________色,同时产生大量的_____________________,反应的化学方程式为______________________________,该反应类型为________________反应。铁片投入_____________色的硫酸铜溶液里,片刻后取出,铁片表面附有_____________色的铜,铁片质量_____________________(填“增加”或“减少”),反应方程式为___________________________________,这是现代_____________冶金的先驱。
29.如下图所示,A、B、C三支试管中的铁钉分别处于不同的环境。将它们放置一周时间,每天进行观察,发现________试管中的铁钉最易生锈。该实验表明,铁生锈实际上是铁跟_______、_______等物质相互作用,发生的一系列复杂的化学反应。
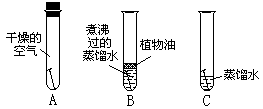 30.可用铁制成烧菜用的锅,这是因为铁具有_______________________________性质;在铁制品表面常喷刷油漆等,这是因为铁容易___________________________________。
30.可用铁制成烧菜用的锅,这是因为铁具有_______________________________性质;在铁制品表面常喷刷油漆等,这是因为铁容易___________________________________。
31.铁有下列性质:①铁是一种银白色的固体 ②铁能传热和导电 ③铁丝加热后放入O2瓶会剧烈燃烧 ④铁在1535℃时变成铁水 ⑤铁能溶解在稀盐酸和硫酸铜溶液中。其中属于铁的化学性质的是________________(填编号)。
32.有X、Y、Z三种元素,它们的原子核内质子数均不超过18,它们能相互形成XZ和YZ型化合物,X2+和氖原子的核外电子排布相同;Y原子和X2+的电子层数相同,但比Z原子少2个电子,Y原子的最外层电子数是次外层的2倍。试求:
(1)X、Y、Z原子核内的质子数 、 、 。
(2)若X、Y、Z的原子核内的质子数与中子数均相等,则化合物XYZ3的式量是 。
33.取2克钢样放在足量的氧气流里灼烧,将生成的气体通入澄清的足量的石灰水中(设生成的气体全部被吸收),得到0.084克白色沉淀,则钢样中碳的质量分数是________________。
34.某Fe2O3样品的含铁量为47.5%,则该样品含Fe2O3的质量分数是________________。
35.50℃时,将不饱和的氯化铵溶液50克,分成两等份。一份蒸发掉5克水,另一份加入2.5克氯化铵,都恰好饱和。则50℃时,氯化铵的溶解度为____________克。
36.河水里的微生物使有机物(以C6H10O5表示)转化为CO2和H2O的过程中所需的O2量叫生化需氧量(BOD),BOD是衡量水体质量的一个指标。
(1)C6H10O5和O2反应生成CO2和H2O的化学方程式为 。
(2)20 ℃时,1.0 升某水体(假使该水的密度为1 克/毫升)中含有机物(C6H10O5)的质量分数为0.0010%。则该水体的BOD为 克/升。
(3)20
℃时,1.0 升水中溶O2 0.0092克。上述水体适合于鱼类生存吗?
。
原因是
。
三、计算题
37.有8克CO2和CO的混合物气体与灼热的氧化铁充分反应,混合气体的质量增加3.2克,则参加反应的氧化铁质量为多少克?原混合气体中CO2的质量是多少克?
38.某钢铁厂日产含4%杂质的生铁2240吨。问:
(1)需要含Fe2 O3质量分数为80%的赤铁矿石多少吨?
(2)若现在只有上述的赤铁矿石2160吨,为确保生铁的日产量不变,还需要含Fe3O4质量分数为56%的磁铁矿石多少吨。
初 三 化 学 练 习 (四) 答 案
一、选择题
1.A 2.D 3.C 4.C 5.C 6.A 7.B 8.A 9.D 10.C 11.B 12.C 13.D 14.B 15.C 16.B、C 17.C、D 18.C 19.D 20.C 21.C 22.C 23.B 24.D 25.C 26.A、D 27.A
二、填空题
28.无,浅绿,气泡,Fe+H2SO4[FY=]FeSO4+H2↑,置换,蓝,红,增加,Fe+CuSO4=FeSO4+Cu,湿法 29.C;空气中氧气;水 30.良好的导热性; 生锈 31. ③⑤ 32.(1) 12、6、8 (3分) (2) 84 33.0.5%34. 67.9%; 35. 50 36.(1) C6H10O5 + 6O2 = 6CO2 + 5 H2O (2) 0.012 (2分) (3)不适于鱼类生存,因为0.012 克/升(BOD) > 0.0092克/升
三、计算题
37.10.7克,2.4克。 38.(1)3840吨…(2)2320吨