 2006年初三毕业班化学模拟试卷
2006年初三毕业班化学模拟试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Na-23 Ag-108
一、选择题( 每小题只有一个选项符合题意)
1.今年3月19日,我市空气质量首次达优级。为继续改善环境质量,你认为下列措施不可行的是( )
A.继续动员全市人民植树增绿 B.积极推广清洁能源和清洁生产
C.鼓励发电厂多烧原煤多发电 D.加强机动车管理,减少尾气污染
2.物质是变化的,我们生活在多姿多彩的物质世界里。下列变化中没有新物质生成的是( )
A.白雪缓慢消融 B.葡萄酿成红酒
C.石蕊遇碱变蓝 D.铜器锈蚀变绿
3.乙醇按一定比例与汽油调和后,就可成为“汽车新饮料”——乙醇汽油。则乙醇汽油属于 ( )
A.无机物 B.化合物 C.纯净物 D.混合物
4.“春蚕到死丝方尽”,这里“丝”的主要成分是( )
A.维生素 B.蛋白质 C.纤维素 D.油脂
5.据《福州晚报》报道,我市明年开始供应天然气。天然气的主要成分是( )
A.一氧化碳 B.甲烷 C.氢气 D.煤气
6.下列对日常生活中某些做法的认识没有科学依据的是( )
A.通常情况下,用硬水洗衣服比用软水洗衣服效果好
B. 从某种意义上说,垃圾也是资源,应分类回收处理
C.菜刀擦干后放在干燥的地方不易生锈
D.失火时,要冷静地根据具体情况,采取相应的措施自救
7.据报道,今年3月广东某金矿发生毒气熏人致死事故,经测定该毒气中含有一氧化碳、二氧化硫、氰化物等。其中一氧化碳、二氧化硫都属于( )
A.氧化物 B.酸 C.碱 D.盐
![]() 8.镍氢电池是近年开发出来的可充电电池,它可以取代产生镉污染的镉镍电池,镍氢电池的总反应式为:2NiO(OH) +H2 2Ni(OH)2。则Ni(OH)2中Ni元素的化合价为(
)
8.镍氢电池是近年开发出来的可充电电池,它可以取代产生镉污染的镉镍电池,镍氢电池的总反应式为:2NiO(OH) +H2 2Ni(OH)2。则Ni(OH)2中Ni元素的化合价为(
)
A.+1 B.+2 C.+3 D. +4
9.打气筒能将空气压入自行车胎内,主要是由于( )
A. 分子的大小发生了变化 B.分子从静止状态变为运动状态
C.分子之间的空隙发生了变化 D.分子的质量发生了变化
| 灭火实例 | 灭火原理 | |
| A | 住宅失火时,消防队员用水灭火 | 降低可燃物的着火点 |
| B | 酒精在桌上着火时,用湿抹布盖灭 | 隔绝空气或氧气 |
| C | 炒菜油锅着火时,用锅盖盖熄 | 隔绝空气或氧气 |
| D | 扑灭森林火灾时,设置隔离带 | 可燃物与燃烧物隔离 |
 10. 据统计,我国仅20世纪90年代就发生火灾约89万起,给人民造成重大损失。应用化学知识能有效预防和控制火灾。下面对图中灭火实例的灭火原理解释不正确的是( )
10. 据统计,我国仅20世纪90年代就发生火灾约89万起,给人民造成重大损失。应用化学知识能有效预防和控制火灾。下面对图中灭火实例的灭火原理解释不正确的是( )
11.某同学观察了如右图所示的实验后,得出以下结论,你认为其中不合理的是( )
|
|
 A.氯化氢分子和氨分子是不断运动的
A.氯化氢分子和氨分子是不断运动的
B.氯化氢和氨气能发生化学反应
|
D.两瓶无色气体混合后瓶内压强增大
12.有些游泳池中的水呈蓝色,是因为加入了一种能杀菌消毒的物质。这种物质可能是( )
A.明矾 B.食盐 C.硫酸铜 D.熟石灰
13.纳米材料在军事上有广泛用途,美国军用飞机F-117的表面就涂有隐身材料——纳米氧化铝等。氧化铝的化学式书写正确的是( )
A. AlO B.AL2O3 C.Al2O3 D.Al3O2
14.国外医学界研究表明,如果人体不缺乏微量元素而随意过量补充,不仅对健康无益,反而有害。下列元素属于人体中微量元素的是( )
A.碳 B.氢 C.氧 D.碘
15.下列有关物质的检验或区分方法中不正确的是( )
A. 向某物质中加入稀盐酸,有无色气体放出,则证明该物质是碳酸盐
B. 鉴别氧气和空气两瓶气体时, 将燃着的木条分别插入瓶中,燃烧更旺的为氧气
C. 鉴别铁粉和石墨粉时,分别加入稀盐酸,若有气体放出,则证明为铁粉
D.某化肥与碱共热,若产生使湿润红色石蕊试纸变蓝的气体,证明为铵态氮肥
二、填空与简答题
16.化学就在我们身边,它能改善我们的生活。请从“A.氧气 B.氮气 C.生石灰 D.熟石灰 E.食醋 F.尿素 G.不锈钢 H.聚乙烯”中选择适当的物质填空(填字母)。
(1)抢救危重病人常用的物质是 ;(2)用于农作物肥料的物质是 ;
(3)常用作袋装食品干燥剂的是 ;(4)厨房调味品中pH小于7的是 ;
(5)可以制成食品包装袋的是 ;(6)可用于制造刀具的物质是 ;
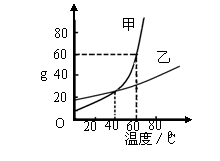 17.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据右图的溶解度曲线回答下列问题:
17.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据右图的溶解度曲线回答下列问题:
(1)20℃时,甲物质的溶解度_____ (填“大于”、“等于”或“小于”)乙物质的溶解度。
(2)_______ ℃时,两种物质的溶解度相等。
(3)60℃时,将80 g 甲物质放入100 g水中,所得溶液的溶质质量分数为 。
18.趣味化学联欢会上,小刚和小强给同学们变起了“魔术”、小刚说:“我会‘水变汽水”。 他边说边将两种无色澄清的液体倒在一起,立刻得到一杯冒着气泡的澄清液体。小强说:“这没什么,我还会‘水变牛奶’呢”。只见他将两种无色澄清的液体倒在一起,果真得到一杯像是‘牛奶’的液体。
(1)“水变汽水”所用的两种澄清液体可能是_________________________________。
(2)“水变牛奶”的“魔术’可以通过许多化学反应来完成,例如(用化学方程式表示)_______________________________________________________________。
(3)请你再设计一个化学“魔术”,写出“魔术 名称和化学反应原理。 ________________________________________________________________。
19. 今年冬天我国内蒙古发生了多起CO中毒事故。由此引发了同学间的争论:

请说出你的看法及理由: 。
|
| 液体 | 血液 | 胰液 | 胃液 | 胆汁 |
| pH范围 | 7.35~7.45 | 7.5~8 | 0.9~1.5 | 7.1~7.3 |
请回答:液体碱性最强的是 。
|
|
一种治疗胃病药物的标签。请回答:
该药物在胃中发生的化学反应的化学方程式是 。
21.  小强设计了一个有趣的实验(如右图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
小强设计了一个有趣的实验(如右图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
(1)下面是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性,
。
(2)若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数 (填“大于”、“等于”或“小于”)原饱和硝酸钾溶液的溶质质量分数。
22.“探险队员”~盐酸,不小心走进了化学迷宫(下图所示),不知怎样走出来,因为迷宫中有许多“吃人的野兽”(即能与盐酸发生反应的物质),盐酸必须避开它,否则就无法通过。请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)。
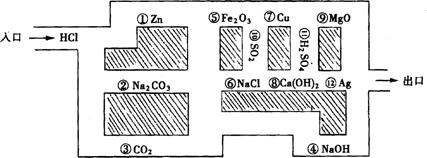
入口→ → → → → → →出口。
23.化学是造福人类的科学,在人体保健、医疗卫生等方面作出了重大贡献。请你用所学的化学知识解答有关问题。
(1)食品安全与健康密切相关。下列做法不会危及人体健康的是( )。
A. 用“苏丹红一号”作食品添加剂 B .蒸馒头时加入适量纯碱
C.加过量亚硝酸钠以保持肉质鲜美, D.把霉大米淘净后继续食用
(2)低血糖患者每天都应注意摄入一定量含淀粉的食物,以使血液中维持一定浓度的葡萄糖。请你列举两种富含淀粉的食物 、 。
(3)油炸食物不宜多吃,因长时间煎炸会产生有毒物质丙烯醛(C3H4O),丙烯醛在空气中完全燃烧时,生成二氧化碳和水。请写出丙烯醛完全燃烧的化学方程式 。
(4)食盐是人维持正常生理活动的重要物质。人体细胞中约含NaCl 0.9%,一般成年人每日需NaCl的量为4.5 g~9 g。
①某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9%的生理盐水,现医生确定每天为他注射200 g生理盐水,则每天可为他补充约 g食盐。
②小明同学根据NaCl+AgNO3=AgCl↓(白)+NaNO3这一反应原理,对一瓶生理盐水进行分析时,不知道加入的硝酸银溶液与氯化钠溶液是否恰好完全反应,于是他设计了一个实验方案进行探究。请你帮他完善该实验方案。
| 探究步骤 | 可能观察到的现象 | 结论 |
| (1)取反应后的上层清液于试管中,滴加 溶液 | 若有白色沉淀生成 | 溶液过量 |
| 若无白色沉淀生成 | 还需进行下一步探究 | |
| (2) 另取反应后的上层清液于试管中,滴加 溶液 | ||
三、实验与探究题
24.为了研究CO2的性质,需要制取并收集干燥的CO2气体。以下是老师提供的一些实验装置。
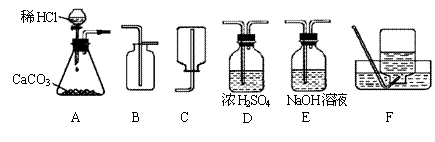 |
(1)制取并收集干燥的CO2气体,可采用的装置组合是 (填字母)。
(2)实验室制取CO2的化学方程式为 。
(3)若在上述实验中气体无法收集满,则可能的原因是 。
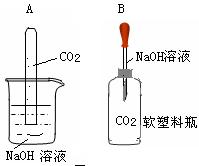 25.化学反应往往伴随着一些现象的发生,但CO2与NaOH溶液的反应没有明显的现象。为了通过一些现象说明CO2与NaOH溶液发生反应,小明和小华分别设计如图两个实验进行探究。
25.化学反应往往伴随着一些现象的发生,但CO2与NaOH溶液的反应没有明显的现象。为了通过一些现象说明CO2与NaOH溶液发生反应,小明和小华分别设计如图两个实验进行探究。
观察到A装置中试管液面上升。B装置的现象为 。同学们经过分析讨论,A 实验中产生液面上升的原因可能有两种。一种是因为CO2与NaOH溶液发生反应,消耗CO2,你认为另一种原因是 。
为了进一步证实CO2与NaOH溶液反应。你认为小华同学应该补做的实验是
。
26.聪聪在用水煮虾的过程中发现青色的生虾煮熟以后变成红色,特别是虾汤的颜色更是鲜红。
(1)提出问题:虾汤中的这些红色物质是什么?
(2)猜想与假设:这种红色物质可能像酸碱指示剂一样,遇酸或遇碱,颜色会发生改变。
(3)收集证据:现在请设计一个简单的探究方案,验证聪聪的猜想:
| 使用的试剂 | 实验操作方法 | 可能的现象 |
(4)以上的探究对你有什么启示?
。
四、计算与分析题
27.一题多解能启迪同学们的思维。如:电解18g的水最多能产生多少克氢气?晓梦同学认为可以根据化学方程式计算。小莹同学认为只要求出18g水中所含氢元素质量便可知道反应生成的氢气质量。小莹同学的解题依据是 。
请你用小莹同学的解题方法把解题过程写出来。
28.散装过氧化氢溶液溶质质量分数约为30% 。小明同学用它来配制溶质质量分数为5%的过氧化氢溶液,做如下实验:取该溶液10g放入烧杯中并加入90g的水,搅拌,再加入1g MnO2 充分反应,质量不再减轻后,称得剩余物及烧杯总质量为171.8g。(烧杯质量72.1g)
求:①反应生成的氧气质量为多少?(精确到0.1g)
②原溶液溶质质量分数为多少?(精确到0.1%)
③配制200g 质量分数为5%的过氧化氢溶液,需要该桶装溶液多少克?(精确到0.1g)
化学反应方程式:2H2O2![]() 2H2O+O2↑
2H2O+O2↑
参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | A | D | B | B | A | A | B | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 |
|
|
|
| 答案 | A | D | C | C | D | A |
|
|
|
二、填空与简答题
16.(1)A (2)F (3)C (4)E (5)H (6)G
17.(1)小于 (2)40 (3)37.5%
18. (1)碳酸钠溶液(碳酸氢钠溶液)、稀盐酸(或其他稀酸)
(2)Na2CO3 + Ca(OH)2=== CaCO3↓+2NaOH
(3)“白酒变红酒”酚酞试液遇碱变红(或表述为:将滴有酚酞试液的水和氢氧化钠溶液混合得到红色溶液)
19.都不完全正确,CO虽然对环境会造成污染,但合理利用可以为人类生产、生活服务。
(言之无理或提出错误观点不能给分)
20.胰液 Al(OH)3 + 3HCl === AlCl3 + 3H2O
21.(1) 浓硫酸具有吸水性,可以吸收硝酸钾溶液中挥发出的水分,使饱和溶液中的溶剂减少,溶质析出。(2)等于
22.入口→③→⑥→⑩→⑦→11→12→出口
23.(1)B (2)略 (3)2C3H4O+7O2 === 6CO2+4H2O (4) ① 1.8
②合理答案均可。
| 探究步骤 | 可能观察到的现象 | 结论 |
| (1) NaCl | AgNO3 | |
| (2))AgNO3 | 若有白色沉淀生成 | NaCl |
| 若无白色沉淀生成 | 两者恰好完全反应 |
三、实验与探究题
24.(1)A、D、C (2)略 (3)药品量不足或气密性不好等。
25.软塑料瓶变瘪 CO2与NaOH溶液中的H2O发生反应(或CO2溶于 NaOH溶液中的H2O),消耗CO2
26.稀盐酸、 NaOH溶液 把红色的虾汤分成三份;向一份中加入稀盐酸,向另一份中加入NaOH溶液与第三份进行颜色对比 加入酸或碱的虾汤的颜色可能会发生变化
(4)要像聪聪那样,善于观察、善于发现、善于思考、大胆猜想;对比实验是一种重要的科学方法。
四、计算与分析题
![]() 27.质量守恒定律
27.质量守恒定律
18g水中所含氢元素质量=
根据质量守恒定律反应生成的氢气质量为2g。
28.①1.3g
②设:10g样品中所含H2O2 质量为x。
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
68 32
X 1.3g 1分
![]()
X=2.76g 1分
![]()
该样品H2O2溶质质量分数=
答:(略)
③设:需该桶装溶液质量为y。
y×27.6%==200g×5% 1分
y=36.2g 1分
答:(略)