长郡教育集团初三年级化学第四次月考试题
时量:90分钟 总分:100分 命题人:明海 2006.1.12
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5
一、选择题(每小题2分,共44分,每小题只有1个正确选项)
1.下列物质属于纯净物的是
A.食盐水 B.澄清石灰水
C.新鲜的空气 D.干冰
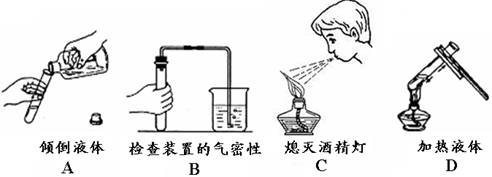 2.下图所示实验操作中错误的是
2.下图所示实验操作中错误的是
3. 在擦玻璃时,人们时常先向玻璃上“哈气”再擦会使玻璃擦得更干净。这说明与空气相比,人体呼出的气体中含有较多的( )
A.二氧化碳 B.氮气
C.水蒸气 D.氧气
4.下图所示的变化中,属于化学变化的是
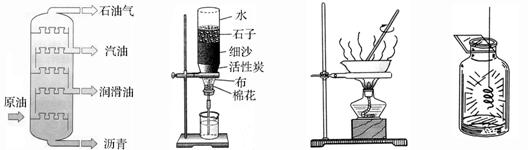
石油分馏 净化水 蒸发食盐水 铁丝在氧气中燃烧
A B C D
5.高铁酸钾是一种新型、高效、多功能的“绿色”水处理剂,其化学式为K2FeO4,已知其中K元素为+1价,O元素为-2价,则Fe元素的化合价为( )
A.+2 B.+4 C.+5 D.+6
6.使用燃气热水器时,若通风不畅易使人中毒。造成中毒的气体是( )
A. 氧气 B. 氮气 C. 一氧化碳 D. 二氧化碳
7.物质的变化常需要在一定条件下进行,通过改变条件可以加快、减缓甚至阻止变化的进行。下列各种做法中,为了加快变化的是( )
A.把食品放入冰箱中冷冻贮藏
B.烧煤时把煤制成蜂窝状,并增大煤炉进风口
C.在金属表面涂上防锈漆以防锈
D.把种子晒干后再储存

8.据报道,长株潭轻轨铁路项目将正式启动。“轻轨电车”是近年来又一新兴的交通工具(如图所示),具有无污染的优点。当轻轨电车开动时,在轻轨电车跟架空电线的接触点上,由于高速摩擦会产生高温,因此接触点上的材料应该具有耐高温、有润滑性、不易氧化、能导电的性质。你认为该接触点上材料的选用较为合适的是
A.金刚石 B.铝
C.石墨 D.铜
9.6月5日是世界环境日。但是,随着人口的增多,经济的增长,空气和水污染加重,酸雨的浇淋,森林的锐减,生物多样性的减少,臭氧层的破坏,土壤荒漠化面积的扩大,以及气候的变化……环境承受的压力越来越大。我们面临着发展和保护环境的双重任务。人类的下列生产活动不会对地球环境造成破坏的是
A.生活污水及工业废水、废气直接向大气排放
B.大量使用煤、石油、天然气等化石燃料
C.大量砍伐森林,以满足建设需要;大量捕杀濒危野生动物,以满足饮食需要
D.把生产和消费过程中产生的废弃物进行收集和处置,回收可利用资源
10.室温下,在厨房中有饱和食盐水、蒸馏水两杯液体。在下列方法中,不能将它们鉴别开来的是
A.看颜色
B.尝味道
C.各取少量,倒入蒸发皿中加热蒸发,看是否有晶体析出
D.各取少量,再加入少量Na Cl固体,看NaCl固体是否能溶解
11.下列化学用语中,“2”表示离子个数的是
A.2K+ B.Cu2+ C.C2H5OH D.CO2
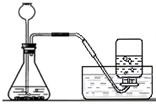 12.利用下列方法制取气体时,可采用右图装置的进行的是
12.利用下列方法制取气体时,可采用右图装置的进行的是
A.过氧化氢的水溶液和二氧化锰制取氧气
B.加热高锰酸钾制取氧气
C.氯酸钾和二氧化锰加热制取氧气
D.石灰石和稀盐酸制取二氧化碳
13. 下列变化中,没有热量放出的是
A.氢气燃烧 B.硝酸铵(NH4NO3)晶体溶于水
C.镁与稀盐酸反应 D.氢氧化钠(NaOH)固体溶于水
14.“国家公众全面营养项目”中提倡食用“强化铁酱油”,即在酱油中加铁,国际上也推广使
用中国的铁锅,这主要是因为( )
A.使食物中增加人体需要的元素
B. 铁在干燥的空气中不易生锈
C.铁锅具有良好的导电性
D. 铁资源丰富,铁制品价格低廉
15.下列化学方程式中,既不属于化合反应、又不属于分解反应,也不属于置换反应的是
A.Fe + CuSO4 == Cu + FeSO4
B.2Cu + H2O + CO2 + O2 == Cu2(OH)2CO3
C.2H2O2 ![]() 2H2O
+ O2↑
2H2O
+ O2↑
D.CuO + CO ![]() Cu + CO2
Cu + CO2
16.我国商代已制造出精美的青铜器,春秋战国时期已会冶炼和炼钢。人类开发利用下列金属单质的时间顺序与金属活动性的强弱有着上述某种内在联系:金属活动性越强,开发和利用其单质的时间一般就越晚。由此推断,下列金属中,人类开发利用最晚的是 ( )
A.Al B.Cu C.Fe D.Zn
17.实验室利用石灰石与稀盐酸反应,制取并收集二氧化碳气体,一定需要用到的仪器是
A.酒精灯 B.集气瓶
C.水槽 D.长颈漏斗
18.据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是
A.日晒风吹使水分蒸发、晶体析出
B.日晒风吹使溶液由饱和变为不饱和
C.日晒风吹使海水中的氯化钠蒸发
D.日晒风吹使氯化钠的溶解度变小

19.右图四位同学正在讨论某一个化学方程式,他们所描述的化学方程式是(相对原子质量:H-1;C—12;O—16;S一32)
A.2H2 + O2 ![]() 2H2O
2H2O
B.2CO+O2 ![]() 2CO2
2CO2
C.S+O2
![]() SO2
SO2
D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
20.化学实验操作的“先”与“后”,对化学实验结果、师生安全等具有十分重要的意义 。下列试验操作先后次序中,错误的是
A.点燃氢气前,先检验氢气的纯度
B.制备气体前,先检查装置的气密性,再装药品
C.加热二氧化锰与氯酸钾混合物制取氧气后,先移导管出水面,后停止加热
D.掏沼气池(沼气池内有大量可燃性气体CH4)前,先进行灯火试验
21.超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料经研磨烧结可合成一种高温超导物质Y2Ba4Cu6O13。下列有关说法中错误的是(注:Y是金属钇的元素符号)
A.上述过程中发生了化学变化
B.Y2O3、BaCO3、CuO和Y2Ba4Cu6O13都属于氧化物
C.在Y2O3 中Y的化合价为+3价
D.在合成Y2Ba4Cu6O13时,一定还会生成一种含碳元素的物质
22.某同学观察到:往紫色石蕊试液中通入CO2气体后,紫色石蕊试液变成了红色。对此,该同学进行了以下探究:
提出假设:①可能是水使石蕊试液变红;②可能是CO2使石蕊试液变红;③可能是H2O与CO2反应后生成的新物质使石蕊试液变红。
查阅资料:酸能使紫色石蕊试液变红。
实验:该同学将一些纸花用石蕊试液浸成紫色后干燥,用这些干燥的紫色纸花进行了以下实验(下图实验I、III、IV中表示纸花均先喷洒水或酸)
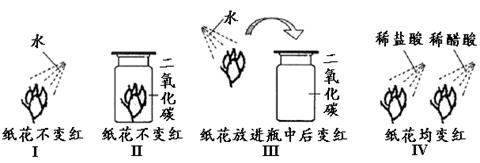
据此,该同学做出了下述结论:
①实验I 和实验II说明:水不能使石蕊变红,二氧化碳也不能使石蕊变红;
②实验I、II、III说明水与二氧化碳反应生成了新物质;
③实验IV近一步说明水与二氧化碳反应生成的新物质很可能属于酸。
其中,正确的有
A.①②③ B.只有①
C.只有①② D.只有②
答 题 卷
一、选择题(每小题2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
二、填空题(每空1分,化学方程式2分,共20分)
23.用化学符号或化学式表示:
2个氮原子_______;带两个单位正电荷的钙离子______ +3价铁元素的氧化物_______
24.请你根据下列物质的有关性质,选用对应物质的序号填空:
①干冰;②活性炭;③沼气;④钛合金;⑤0.9%的NaCl溶液
(1)白糖与红塘,主要成分都是蔗糖。利用其吸附性,可将红糖脱色变成白糖的是_____;
(2)可用于人工降雨的物质是_____;
(3)密度因小、延展性好、耐腐蚀性强,广泛应用于航海、航空和化学工业的是____。
25.某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中。该元素的原子结构示意图为![]() ,则x为 ,该元素属于 (填“金属”或“非金属”)元素。
,则x为 ,该元素属于 (填“金属”或“非金属”)元素。
26.随着经济的发展,人口的增长,水资源短缺的问题日益突出。下列资料
是我国部分地区人均水量图和水资源紧缺指标表。
资料一:我国部分省市人均水量图
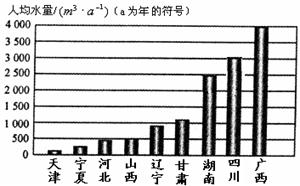
资料二:水资源紧缺指标表
| 紧缺性 | 极度缺水 | 重度缺水 | 中度缺水 | 轻度缺水 |
| 人均水量 | <500 | 500~1000 | 1000~1700 | 1700~3000 |
(1)上面的两张图表提供的有关数据资料显示,我们湖南省属于_________缺水型省份。
(2)自然界中采集到的湖水、河水的水样,一般比较浑浊,可通过(填一种操作方法)______________的方法,得到较澄清的水样。
(3)自来水厂常用氯气(Cl2)对自来水进行消毒杀菌,但残余的氯气对人类健康不利,故自来水厂常加入适量的活性炭以消除残余的氯气,反应时碳与氯气、水共同作用,得到盐酸(用HCl表示)和二氧化碳,请写出该反应的化学方程式________________________。
(4)使用硬水会给生活和生产带来许多麻烦。家庭生活中可以用______________检验某水样是硬水还是软水。
|
(2)将含有未溶解的蔗糖晶体的溶液A,从冰箱里取出放置一段时间后,晶体慢慢消失,形成溶液B。对于溶液A和B,一定处于饱和状态的是的是 。
28. 探究植物光合作用与呼吸作用的比较。
![]()
![]()
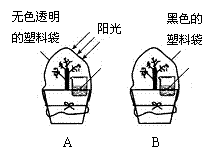 植物不但进行光合作用,也同时进行呼吸作用。为了比较二者的不同,有人设计了如下实验。 在一晴朗的早晨,选取大小相似的同种植物两盆,在花盆上各放入一杯澄清的石灰水,然后把其中一盆用无色透明的塑料袋罩住,放在阳光下;另一盆则用黑色塑料袋罩住,放在阴暗处(见图)。傍晚,在塑料袋上都剪一小口,并插入燃着的木条试验,发现A中木条比B中更亮;而A中的石灰水保持澄清,B中变浑浊。
植物不但进行光合作用,也同时进行呼吸作用。为了比较二者的不同,有人设计了如下实验。 在一晴朗的早晨,选取大小相似的同种植物两盆,在花盆上各放入一杯澄清的石灰水,然后把其中一盆用无色透明的塑料袋罩住,放在阳光下;另一盆则用黑色塑料袋罩住,放在阴暗处(见图)。傍晚,在塑料袋上都剪一小口,并插入燃着的木条试验,发现A中木条比B中更亮;而A中的石灰水保持澄清,B中变浑浊。
(1)A中木条燃烧更旺,说明A中 更多,从而说明在阳光照射下植物主要发生 作用。
(2)A中石灰水保持澄清,而B中变浑浊,说明B中 更多,从而说明在缺少光照条件下,植物主要发生 作用。
(3)很多人喜欢在天刚蒙蒙亮时到茂密的林中进行晨练,请你结合该实验谈谈看法。
三、简答题(共3小题,其中29、30题每小题4分,31小题6分,共14分)
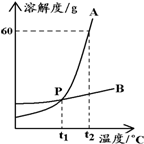 29.如图为A、B两种固体物质的溶解度曲线。从图中你还可
29.如图为A、B两种固体物质的溶解度曲线。从图中你还可
获得哪些信息?请你写出其中的两条:
信息一:_____________________________________________
信息二:______________________________________________
30.某学生为了确定何种金属与稀硫酸(H2SO4)反应制取氢气,分别用2.0g铁屑、锌粒、镁片和足量的稀硫酸反应。完全反反应时所需的时间与当地的金属价格如下表所示。请你回答相关问题:
| 物质 | 所需时间 | 价格 |
| Fe | 约27800秒 | 10.00元/1000g |
| Zn | 约100秒 | 40.00元/1000g |
| Mg片 | 约20秒 | 432.00元/1000g |
(1)你认为应选用的金属是___________;
(2)你选用这种金属的理由有哪些?
31.有A、B、C、D、E、F、G、H等八种物质,它们有如下图所示的转化关系。已知无色气体E是一种能与血红蛋白结合而使人中毒的有毒气体,红色固体G是导电性仅次于银的金属。回答下列问题:
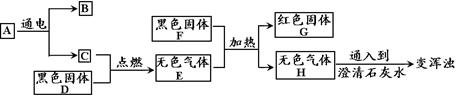
(1)写出指定物质的化学式:A_____________ B ___________
(2)写出C与D反应的化学方程式:___________________________________________
写出E与F反应的化学方程式:_____________________________________________
四、实验与探究题(每空1分,化学方程式2分,共16分)
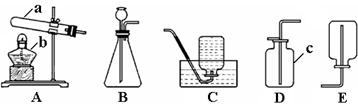 32.现提供下列实验装置,请你回答:
32.现提供下列实验装置,请你回答:
(1)写出指定仪器的名称:
a _______________ b________________ c_______________
(2)根据氧气不易溶于水的性质,对应的氧气的收集装置应选_____(填装置序号,下同)。
(3)实验室若用石灰石与稀盐酸反应来制取二氧化碳,则发生装置应选用______。收集二氧化碳不能选用装置E的理由是__________________。
(4)铜绿的主要成分为〔Cu2(OH)2CO3〕,为绿色固体。在加热时,易分解生成氧化铜、水和二氧化碳气体。则加热铜绿的装置应选用______,检验生成的二氧化碳气体可使用澄清石灰水,此时实际上是CO2与石灰水中的溶质_________________(填化学式)发生反应。
33.“用双氧水和二氧化锰制氧气”的反应方程式为: ____ 。
实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实 验 次 序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
请分析表中数据并回答有关MnO2的用量对反应速率的影响情况:
当催化剂MnO2的用量增加时,反应速率___________(填“加快”、“减慢”或“不变”),当催化剂MnO2的用量增加到一定程度时,反应速率 。
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
| 实 验 次 序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540mL气体时所用时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度(℃) | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率的影响情况是:__________________________________________________________________________ ,表中数据还可看出,该反应是个 反应(填“放热”或“吸热”)。
(3)由此可看出,催化剂的用量、过氧化氢溶液的浓度(即溶质质量分数)等都是影响过氧化氢分解的反应速率的因素。
实际上,影响化学反应速率的因素还有很多。请你仿照示例,结合实际生活中的例子,再举一例。
示例:温度越高,反应越快。如在高温时,铜在空气中容易被氧化。
。(2分)
五、计算题(6分)
34.一定质量的碳酸钠粉末与200g某稀盐酸恰好完全反应,化学方程式为Na2CO3 + 2HCl == 2NaCl + CO2↑+ H2O。恰好反应后,生成8.8g二氧化碳气体。求:
![]() (1)碳酸钠粉末的质量;
(1)碳酸钠粉末的质量;
(2)该稀盐酸的溶质质量分数(提示: )
参考答案
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | C | C | D | D | C | B | C | D | A | A |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | A | B | A | D | A | B | A | A | D | B | A |
二、填空题
23.2N Ca2+ Fe2O3
24.② ① ④
25.20 金属
26.(1)轻度 (2)过滤 (3)2Cl2 + C + 2H2O == CO2 + 4HCl (4)肥皂水
27.(1)变小 (2)A
28.(1)氧气 光合作用
(2)二氧化碳 呼吸作用
(3)此时氧气含量偏低,二氧化碳含量偏高,不利于锻炼。最好是天亮一断时间后进行锻炼。(其他合理答案均可)
三、简答题
29.①t1℃时,A、B两种物质的溶解度相等
②t2℃时,A的溶解度为60g
③A的溶解度受温度影响较大
………………(其他合理答案均可)
30.(1)锌 (2分)
(2)锌的价格便宜,与酸反应速度适中(或回答Fe或Mg的缺点均可,2分)
31.(1)H2O H2
(2)2C + O2 ![]() 2CO CO + CuO
2CO CO + CuO ![]() Cu + CO2
Cu + CO2
四、实验与探究题
32.(1)试管 酒精灯 集气瓶
(2)C
(3)B 二氧化碳密度比空气大
(4)A Ca(OH)2
33. 2H2O2 ![]() 2H2O
+ O2↑
2H2O
+ O2↑
(1)加快 不变
(2)质量分数越大,反应速率越大。 放热
(3)接触面积越大,反应越快。如煤制成蜂窝状后易燃烧些(或纸张撕碎后易燃烧些等合理答案均可)
五、计算题
34.21.2g 7.3%