常乐初中第二次阶段性过关测试
初三化学试 2006.11.3
考试时间100分钟 总分100分 制卷人: 审核人:
可能用到的相对原子质量:C:12 H:1 O:16 N:14 S:32 K:39 Cl:35.5
第Ⅰ卷(选择题 共40分)
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.下列都是生活中常见的物质,其中属于纯净物的是
A.黄酒 B.冰水 C.碘盐 D.硬水
2.下列生活事例中,主要过程为化学变化的是
A.功夫深,铁杵成针 B.佳节到,焰火缤纷
C.春天来,冰雪消融 D.美酒开,满屋飘香
3.世界上的物质有千万种,但组成这些物质的元素只有一百多种,这些元素在地壳中几乎都有,但含量却不相同。地壳中含量最多的金属元素是
A.氧 B.硅 C.铝 D.铁
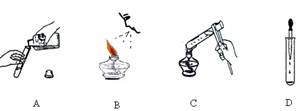
4.下图是几位在实验室操作时的图片,其中正确的是
| 饮用天然水理化指标 钙≥4.5mg/L 镁≥0.4 mg/L 钾≥0.36 mg/L 钠≥0.81 mg/L 偏硅酸≥1.79 mg/L PH(25℃)7.2 |
5.右图是某饮用天然水的部分商标图,图中列出了理化指标。据此回答这里的钙、镁、钾、钠指的是
A.原子 B.分子
C.离子 D.元素
6.空气质量日报是环境监测部门对一个地区空气质量情况所做的监测报告。目前计入空气主要污染物的是可吸入颗粒物、一氧化碳、二氧化硫、氮的氧化物。下列情况能直接造成空气污染的是
A.把煤作为主要燃料 B.随意丢弃塑料垃圾
C.随意丢弃废电池 D.利用太阳能、风能等清洁能源
7.苏丹红一号是一种增色添加剂,可能使人体致癌,其化学式为C16H12N2O,下列关于它的说法错误的是
A. 它是一种氧化物
B. 它所含元素中,质量分数最高的是C元素
C. 它的分子中,碳、氢、氮、氧原子个数比为l6:12:2:1
D.它所含碳、氢、氮、氧元素的质量比为48:3:7:4
8.“神六”于10月12日顺利升空。在太空舱里,为了保持舱内O2 、CO2 气体含量相对稳定,常用NiFe2O4作催化剂将宇航员呼出的CO2转化为O2 。NiFe2O4中铁为+3价,则Ni的化合价为
A.+1 B. +2 C. +3 D.+4
![]() 9.高级汽车中常配置有一种汽车安全气袋,内部贮存有硝酸铵。当汽车高速行驶中受到猛烈撞击时,硝酸铵可发生如下反应:2NH4NO3
9.高级汽车中常配置有一种汽车安全气袋,内部贮存有硝酸铵。当汽车高速行驶中受到猛烈撞击时,硝酸铵可发生如下反应:2NH4NO3![]() 2N2↑+O2↑+4 。则 中的物质应为
2N2↑+O2↑+4 。则 中的物质应为
A.H2 B.H2O C.H2O2 D.HNO3
10.据英国《自然》杂志报道,科学家最近研制成了以锶原子做钟摆的“光晶格钟”,成了世界上最精确的钟。已知一种锶原子的相对原子质量为88,其质子数是38,则这种锶原子的核外电子数为
A.38 B.50 C.88 D.126
11.右下图四位同学正在讨论某一个化学方程式表示的意义,根据他们描述的内容,试判断他们所指的化学方程式是
 A.S+O2
A.S+O2![]() SO2
SO2
B.2CO+O2![]() 2CO2
2CO2
C.2H2+O2![]() 2H2O
2H2O
D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
12.在一个密闭容器内有M、N、X、Y四种物质,在一定条件下反应一段时间后,测得反应前后各物质量如下:
| 物质 | M | N | X | Y |
| 反应前质量/g | 8 | 11 | 18 | 10 |
| 反应后质量/g | 8 | 33 | 4 | 2 |
下列能正确表示容器中化学变化的表达式是
A.X+Y=M+N B.X+Y=N
C. N=M+X+Y D. X+Y+M=N
13.下列物质在氧气中燃烧的实验现象描述正确的是
A.镁条在氧气中燃烧时,有黑色固体生成
B.蜡烛在氧气中燃烧时,有水和二氧化碳产生
C.铁丝在氧气中燃烧时,火星四射,有黑色熔融物生成
D.硫粉在在氧气中燃烧时,有淡蓝色火焰产生,生成刺激性气味的气体
14.化学概念在逻辑上可能存在下图所示关系:对下列概念说法正确的是
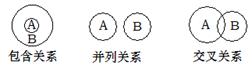 A.纯净物与混合物属于包含关系
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于并列关系
C.单质与化合物属于交叉关系
D.化合反应与分解反应属于并列关系
15.下列微粒符号中,对“2”含义的理解不正确的是
A.2Ca中的“2”表示2个钙原子
B.Fe2+中的“2”表示每个亚铁离子带有2个单位的正电荷
C.H2S中的“2”表示一个硫化氢分子中含有两个氢原子
D.Fe 2 (![]() 4)3 中化学式上方的“2”表示硫元素为-2价
4)3 中化学式上方的“2”表示硫元素为-2价
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意)
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
16.科学家用计算机模拟后确认,60个N原子可结合成N60分子。下列关于N60的叙述中正确的是
A.N60是一种新型的化合物 B.一个N60分子中含有30个N2分子
C.N60的相对分子质量为840 D.N60和N2混合后形成的是混合物
17.水和空气与人类、动植物的生存发展密切相关。下列有关水和空气的叙述中正确的是
A.人们饮用的纯净水中不含任何化学物质
B.水是生命之源,要防止水体污染,节约用水
C.目前计入空气质量日报的主要污染物中包括二氧化碳
D.使用太阳能会加剧酸雨、温室效应等环境问题
18.下表列出了一些生活中常见元素的原子结构示意图。下列叙述错误的是( )
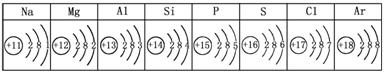
A.上表中,8种元素原子的核外电子层数相同。
B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子。
C.上表中,非金属元素原子的最外层电子数都大于4个。
D.从Na到Ar,随着核电荷数递增,原子核外最外层电子数从1递增到8。
19.电子消毒橱是饮食行业中常用的设备,其中的臭氧(O3)发生器在消毒过程中,将空气中的氧气转化为臭氧。下列有关说法中正确的是
A.该设备消毒时发生了化学变化
B.氧气和臭氧在物质分类上都属于单质
C.氧气和臭氧混合在一起得到的是纯净物
D.氧气和臭氧的化学性质相同,物理性质不同
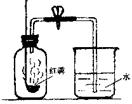 20.右图所示装置可用来测定空气中氧气的含量。对该实验认识不正确的是
20.右图所示装置可用来测定空气中氧气的含量。对该实验认识不正确的是
A.红磷的量不足会影响实验结论
B.装置不漏气是实验成功的重要因素之一
C.将红磷改为碳也能得到正确的实验结论
D.集气瓶内气体压强的减少会导致水面的上升
第Ⅱ卷(共60分)
三、填空题(共8道小题,每空1分,共31分)
21.(4分) 用适当的数字和符号填空:
(1) +2价的锌元素 ; (2)二个镁原子 ;
(3)三个五氧化二磷分子 ;(4)二个碳酸根离子 ;
22.(4分)写出下列反应的化学方程式。
(1) 红磷在空气中燃烧: ;
(2) 铁钉放入硫酸铜溶液中 ;
(3) 用双氧水和二氧化锰制氧气 ;
(4)镁在氧气中燃烧 。
23.(3分)下图形象地表示了在高温催化剂条件下,某化学反![]()
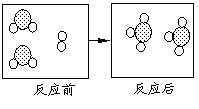 应前后反应物与生成物分子及其数目的变化,其中
应前后反应物与生成物分子及其数目的变化,其中 ![]() 表示硫原子,
表示氧原子,则该反应的化学方程式为:
。
表示硫原子,
表示氧原子,则该反应的化学方程式为:
。
你还可以由此得到哪些信息: ;
。(至少写两条)
24.(5分) 右图为电解水的装置,据实验的有关现象回答:
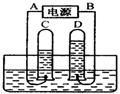 ①A为电源的_____极,(填正或负)D管中气体的检验方法是用__________________________________来检验。
①A为电源的_____极,(填正或负)D管中气体的检验方法是用__________________________________来检验。
②如D管中气体的密度是C管中气体密度的16倍,
则C管中气体与D管中气体的质量比为________。
③由实验得出水是由______________组成的,你认为还可得出哪些结论?__________________________________________(只需说一条)
25.(4分)人们可以对物质从不同的角度进行分类。请将氢气、一氧化碳、氧化镁、二氧化碳、铝和红磷等六种物质分成二组(填化学式),写出分类依据:
第一组: ,分类依据是 。
第二组: ,分类依据是 。
26.(4分)蒸馏水、矿泉水(该矿泉水属于硬水)、白醋、酒精都是常见的无色液体,它们的外观非常相似,其中具有酸味的是 ,另一种具有特殊气味的是 ;其它两种无色液体可用多种方法区分。
例如:(1)加入 (填序号),根据产泡沫的多少来区分;
①肥皂水 ②活性炭 ③食盐水
(2)将这两种无色液体分别加热,完全蒸发,根据是否有 (填现象)来区分。
27.(6分)物质结构决定物质性质。已知氢元素原子的核电荷数为1。试分析:
⑴CaH2是一种离子化合物,其中Ca元素的化合价为+2,则该化合物中氢元素的化合价为 。已知反应物中具有还原性的物质,发生氧化反应后,元素化合价升高。请判断CaH2+2H2O=Ca(OH)2+2H2↑反应中,反应物 (填化学式)具有还原性。
⑵最新科技报道,夏威夷联合天文中心的科学家在宇宙中发现了氢元素的一种新粒子,它的组成可用H3+表示。1个H3+粒子中含有 个质子, 个电子。
⑶物质的性质中,有些对我们人类有利,也有些对我们有害,真是“让我欢喜让我忧”。请你仿照示例,选择一种物质填写下表:
| 物 质 | 有利的一面(用途) | 不利的一面(危害) |
| 示例:氧气 | 供给呼吸,支持燃烧 | 引起金属生锈和食物腐败 |
28.(1分)某化合物16克,在氧气中完全燃烧,生成44克二氧化碳和36克水,通过计算求该化合物的化学式 。
四、实验探究题(本题包括两小题,共19分)
29.(10分)马强和几位同学在实验室用下列装置制取几种气体:
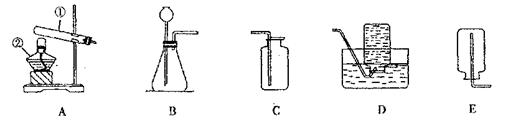 |
(1)写出图中标有①、②的仪器名称:① ,② 。
(2)马强用高锰酸钾制取氧气,他选择上述装置中的A作为制取装置。你认为A装置中还缺少 。写出该反应的化学方程式 。如果采用排水法收集氧气,应该与 装置连接,此时当收集满氧气后,应该如何操作 ? 。实验结束后,陈超问:“我怎么知道这气体就是氧气?”请你设计实验消除他的疑问:
。
(3)陈超用同时想到在实验室中用电解水的方法来得到氧气,试分析此方案是否实用? 。
(4)实验室选用B和C装置可制取氧气,判断O2已收集满的方法是 。
写出制取该气体的化学方程式 。
30.(9分)元素周期表是学习和研究化学的重要工具,下表是原子序数为1—18号元素的原子结构示意图。
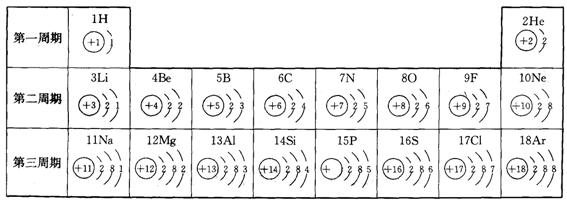
(1)原子序数为12的元素名称为________,其原子核外有_____个电子层,化学反应中易______(填得到、失去)电子,形成______________(填阴离子或阳离子)。
(2)根据上图总结出:原子序数等于原子的核电荷数,你还能找出哪些规律,至少写3条:
①___________________________________________________________________
②___________________________________________________________________
 ③___________________________________________________________________
③___________________________________________________________________
(3)溴(Br)原子结构示意图为 ,应位于第______周期。它的化
学性质与上表中第二周期________元素化学性质相似。
五.计算分析题(本题包括两小题,31题4分,32题6分,共10分)
31.(4分)小强同学在去路口的路边的围墙上看到一则化肥广告:

回校后,小强通过计算氮的质量分数发现该广告是虚假广告。
(1)请你写出小强的计算过程和判断依据。
(2)小强认为此广告会坑害农民,向有关部门反映,技术监督局对该产品取样分析,发现其氮元素质量分数仅为12.0%,则该产品中碳酸氢铵的质量分数为多少?
32.(6分)某同学在一探究活动中需要氧气4.8克,他想通过用氯酸钾来制得这些氧气,请你帮他计算一下:他至少需要氯酸钾多少克?
答案:
一、单项选择题
1、B 2、B 3、C 4、A 5、C 6、D 7、C 8、A 9、A 10、B
11、C 12、C 13、B 14、A 15、B 16、C 17、B 18、C 19、A 20、A
提示及解析:
1、抓住物理变化和化学变化判断的根本特征是是否有新物质生成。A中仅有形状的改变,C中为状态的改变,D中仅有分子的运动,都没有新物质生成,而B中有燃烧的过程有新物质生成,为化学变化。
3、是地壳中含量最多的金属元素是铝。
5、纯净物与混合物的判断。要熟记常见的生活中的混合物。如:A中至少有酒精和水分子,B中肯定有氧气和氮气,D中更有多种分子,因此均为混合物,而C中仅有水分子为纯净物。
7、抓住题中的关键信息是固体碘和碘蒸汽均能使淀粉变蓝。说明只要是同种分子,不管它是什么状态均具有相同的性质。
8、考查空气污染的主要来源是矿物燃料燃烧时产生的有害气体和固体粉尘,还有汽车排出的有害气体。
9、考查化学式的意义及其它相关信息。A中氧化物是由两种元素形成的化合物,其中一种是氧元素,不属于题意,而再通过分析计算,B、C、D均符合题意。
10、考查化合价的应用,已知化学式求化合价。①标出已知元素的化合价和未知元素的化合价;②列出正、负化合价代数和为零的等式,求其中的未知元素的化合价。
11、考查常见气体的检验,如有空气和二氧化碳,则需用燃着的木条来检验,如能使燃烧着的木条燃烧更旺,证明是氧气,而如果使燃烧着的木条熄灭,证明是二氧化碳。
12、考查化学性质与最外层电子数之间的关系。最外层电子相同,化学性质相似,题中所提供的原子的最外层电子数为5,与C中最外层电子数相同,化学性质相似。
13、考查质量守恒定律,在化学反应前后,元素的种类和原子的个数没有改变,从而确定其化学式,注意所考查物质前是否有系数。
14、考查原子中原子序数、质子数、核外电子数之间关系,在原子中,原子序数=质子数=核外电子数。
15、由性质可决定其收集方法,反之由收集方法而推知其性质,NO只能用排水法收集,说明它可能与空气中某物质能发生反应,而且密度可能与空气密度相近,而不与水反应,且不溶于水。
16、考查化学方程式的意义,由题中所提供四个住处可能综合得出这应该是指C中的化学方程式。
17、考查化学变化中原应物,生成物的质量特点。在化学反就中,反应物质量减少,生成物质量增加,由此判断M没有参加反应,N为生成物,X、Y为反应物。
18、注意实验现象与实验结论的区别,A、D中描述错误,B中写出的实验结论。
19、考查核外电子排布的特点及离子中质子数与核外电子之间的关系,当第三层已排8电子,说明第二层已排满,即为8电子,由此说明此离子核外共有18个电子,且带一个单位负电荷,则核内为17个质子。
20、要学会从题目中分析得出相关结论,由题中所给信息,可以判断A为正确。
二、不定项选择题
21、CD 22、B 23、B、C 24、B 25、C
提示:
21、此题为高起点、低落点的试题,其实是考查化学式的意义,可以根据化学式的意义来找出相关的正确答案为C、D。
23、要学会从题中找规律,找出各自的异同点,从而比较得出结论A、C、D为正确,即B为答案。
三、填空题
![]() 26、(1)O2
(2)2Mg (3)
26、(1)O2
(2)2Mg (3) ![]() (4)CO32-
(4)CO32-
(5)3P2O5 (6)Ar (7)![]() (8)
(8)![]()
化学用式的考查,注意规范、完整。
27、(1)![]()
(2)Fe+CuSO4==FeSO4+Cu
(3)Zn+H2SO4==ZnSO4+H2↑
 (4)
(4)![]()
28、2SO2+O2 2SO3
①1个SO2分子由两个氧原子,一个硫原子构成。
②每2个SO2分子与1个O2分子反应生成2个SO2分子。(其它合理亦可)
29、
 |
30、考查分类的方法,并理解分类的标准的应用。
第一组 CO MgO CO2 氧化物 H2O Al2O3
第二组 H2 Al P 单质 Fe O2
四、实验探究题
31、(1)①试管 ②酒精灯
(2)棉花
![]() D 先从水槽中撤离导管,再熄灭酒精灯。用带火星的木条伸入集气瓶中,如带火星的木条复燃,证明是O2
D 先从水槽中撤离导管,再熄灭酒精灯。用带火星的木条伸入集气瓶中,如带火星的木条复燃,证明是O2
(3)不行 产生氧气的速度太慢
(4)H2 Zn+H2SO4==ZnSO4+H2↑
32、![]()
(1)小于0.7g时,MnO2的用量越大,反应速率越快。当大于0.7g时,无影响。
(2)有,质量分数越大,反应速率越大,放热
(3)环境温度对反应速率有没有影响呢?
五、计算分析题
33、(1)解:纯净的NH4HCO3中氮的质量分数=![]() ×100%=17.7%,而广告中含氮量为19.8%>17.7%,属虚假广告。
×100%=17.7%,而广告中含氮量为19.8%>17.7%,属虚假广告。
(2)解:设样品质量为m,纯度x,则有
m·12%=m·x·17.7%
解得x=67.8%
34、解:设制取3.2g O2至少需要氧气质量为x,
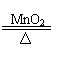 |
2KClO3 2KCl+3O2↑
245 96
x 3.2g
![]()
解得:x=8.2g
答:略。
注意:根据化学方程式计算的格式。