05-06学年第二学期第一次模拟考试
初三化学试卷
(考试时间:90分钟 总分100分)
一、单项选择题:(每题2分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
1. 下列化合物中,属于碱的是。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
2、下列化学肥料属于复合肥料的是
A. (NH4)2SO4 B. KNO3 C. Ca(H2PO4)2 D. CO(NH2)2
3. 下列金属和酸不能发生反应生成氢气的是。
A. 铝和稀硫酸 B. 铁和稀盐酸 C. 锌和稀盐酸 D. 镁和稀硝酸
4、下列各组物质中属于同一种物质的是
A、纯碱 火碱 烧碱 B、盐酸 氯酸 氢氯酸
C、熟石灰 消石灰 氢氧化钙 D、硫酸 氢硫酸 亚硫酸
5. 下列气体中,即可以用浓硫酸干燥,又可以用氢氧化钠固体干燥的是。
A. ![]() B.
B. ![]() C. CO
D.
C. CO
D.
![]()
6. 稀硫酸中加入少量下列固体,溶液酸性的强弱程度不变的是。
A. 氧化镁 B. 碳酸钾 C. 氯化钡 D. 氢氧化铜
7. 不用其他试剂鉴别(1)![]() ;(2)
;(2)![]() ;(3)
;(3)![]() ;(4)
;(4)![]() 四种溶液,则被鉴别出来的物质的顺序正确的是。
四种溶液,则被鉴别出来的物质的顺序正确的是。
A. (1)(2)(3)(4) B. (3)(1)(2)(4)
C. (4)(2)(1)(3) D. (4)(3)(2)(1)
8、几种作物适宜生长的pH范围如下:水稻6.0~7.0、棉花6.0~6.8、甘蔗6.0~8.0、烟草5.0~6.0、茶树5.0~5.5。取某地土壤浸出液加几滴紫色石蕊试液,溶液略显蓝色。则这种土壤适宜种植的作物是
A.水稻 B.棉花 C.甘蔗 D.茶树
9. 下列物质在敞口的容器中放置一段时间后,质量减轻的是。
A. 浓硫酸 B. 浓盐酸 C. 澄清的石灰水 D. 氢氧化钠溶液
10. 下列溶液中,能使紫色石蕊溶液变红的是。
A. 稀醋酸 B. 氢氧化钠 C. 硫酸氢钠 D. 氯化钾
11. 在反应物或生成物中肯定没有单质的是
A、分解反应 B、化合反应 C、置换反应 D、复分解反应
12. 为鉴别稀硫酸和氢氧化钾溶液,提供以下药品和试剂:(1)澄清石灰水;(2)碳酸钠溶液;(3)紫色石蕊试液;(4)酚酞试液;(5)锌粒;(6)氯化钡溶液;(7)氢氧化铜;(8)氯化铁溶液,能够将这两种溶液区分开的是。
A. 全部 B. 除(1)外
C. 除(6)外 D. (1)(3)(4)(5)(8)
13. 下列有关物质的检验或区分方法中不正确的是
A.向某物质中加入稀盐酸,有无色气体放出,则证明该物质是碳酸盐
B.鉴别空气和氧气两瓶气体时,将燃着的木条分别伸入瓶中,燃烧更旺的为氧气
C.鉴别铁粉和石墨粉时,分别加入稀盐酸,有气体放出的为铁粉
D.某化肥与碱共热,若产生使湿润红色石蕊试纸变蓝的气体,证明为铵态氮肥。
14. 下列物质的转化不能由一步反应完成的是。
A. ![]() B.
B.
![]()
C. ![]() D.
D.
![]()
15. 向分别盛有少量氯化钾、氯化钡、碳酸钾溶液的三支试管中滴入2~3滴某种试剂,便能区别开这三种溶液,该试剂是。
A. 硝酸银溶液 B. 氢氧化钙溶液 C. 盐酸 D. 硫酸溶液
16. 2006年1月我县某技校和某高中曾相继发生学生食物中毒事件,引起了全社会的广泛关注,经查原来是误食NaNO2所致,你认为NaNO2的类别以及其中氮元素的化合价应该分别是
A.盐、+5价 B.碱、+5价 C.盐、+3价 D.氧化物、+3价。
17. 学习化学时会遇到很多“相等”,下列有关“相等”的说法中错误的是
A.原子中核内质子数和核外电子数一定相等
 B.中和反应中参加反应的酸和碱的质量一定相等
B.中和反应中参加反应的酸和碱的质量一定相等
C.溶液稀释前后溶质的质量一定相等
D.物质发生化学变化前后,元素的种类一定相等
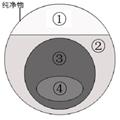
18. 右边图示表示的是纯净物、单质、化合物、含氧化合物、氧化物之间的包含与不包含关系,若整个大圆圈代表纯净物,则在下列选项中,能正确指出①、②、③、④所属物质类别的是。
A.①单质、③氧化物 B.②化合物、④氧化物
C.①单质、③化合物 D.②含氧化合物、④氧化物。
19. X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是:
① Z + YSO4 = ZSO4 + Y ② X + YSO4 = XSO4 + Y
③ Z + H2SO4 =ZSO4 +H2↑ ④ X + H2SO4不发生反应
A.Z>X>Y B.Z>Y>X C.X>Y>Z D.X>Z>Y。
20. 下列对物质用途的叙述正确的是
A、由于盐酸能够跟金属起反应,所以不能用于金属除锈
B、氢氧化钠常用来改良酸性土壤
C、由于浓硫酸具有脱水性,所以常用作某些气体的干燥剂
D、熟石灰与硫酸铜混合在一起配制波尔多液。
二、填空题(化学方程式每空2分,共38分)
21.填表题(种类:酸、碱、盐、氧化物)4分
| 物质名称 | 碳酸氢钠 | 氢硫酸 | 干冰 | |
| 化学式 | Fe(OH)3 | |||
| 种类 |
22、(4分)小红同学通过查阅资料、向医生和化工厂的工作人员访谈,了解到生活中下面一些做法都用到碱,如(1)烧碱、(2)氨水(3)氢氧化铝、(4)熟石灰等,请在下列做法后的空格中填上相应的碱的序号
(1)用于制造肥皂的碱______ ____; (2)用于制氮肥的碱_____________;
(3)作为中和胃酸药物的碱__________;(4)作为建筑材料的碱___________;
23、(5分)某溶液的pH值等于零,该溶液呈______性,滴入紫色石蕊试液变_____色。若溶液的pH值大于7,此时加入酚酞液变_______色。氯化氢、硫酸氢钠、浓硫酸分别溶于水,三者电离出的相同离子是______,其中______不属于酸类。
24. (4分)稀释浓硫酸时,一定要把______沿器壁慢慢倒入______里,并用______不断搅拌,使产生的______迅速地扩散。
25、(2分)分别把10gSO3、CaO、NaCl和CuSO4·5H2O分别溶于90g水中,所得溶液中溶质的质量分数最小的是 (该题都填溶质的化学式);所得溶液的pH<7的是 。
26、(2分)亚硝酸钠对人体健康的危害,正越来越受到科学界的重视。亚硝酸钠有咸味,外形与食盐很相似。但亚硝酸钠的水溶液显碱性,食盐的水溶液显中性。根据以上文字的叙述,鉴别亚硝酸钠和食盐溶液应选用的试剂为 证明是亚硝酸钠溶液的现象为
27、(4分)某校“酸雨”(pH<5.6)测量小组的同学,取刚降落雨水的水样,用pH探头(测pH的仪器)每隔几分钟测一次pH,其数据见下表:
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
(1)根据所学的有关知识,推测“正常雨水”的pH________7(填“>”、“=”、“<”)。
(2)根据以上数据,判断所降雨水是否为“酸雨” _______。(填“是”或“否”)
(3)经调查,这一地区有一个硫酸厂(生产过程中产生SO2)和一个电镀厂,这些厂使用的燃料主要是煤。试分析造成这一地区酸雨的主要原因是_______。其治理措施是改用水能、核能和太阳能等,或将工厂产生的废气通入_______中。
28、(3分)铁锈的主要成分是_________,为除去铁钉上的锈迹,某学生将带锈迹的铁钉放入过量的盐酸中,他首先看到锈迹溶解,溶液呈________色;不一会儿,又看到溶液中有__________产生,这是因为铁钉部分溶解。
29、(2分)实验室制取有毒的氯气(Cl2)时,常用烧碱溶液来吸收多余的氯气,其反应的化学方程式为Cl2+2NaOH=NaClO+NaCl+H2O (其中NaClO是次氯酸钠,C1O叫次氯酸根)。试写出工业上以氯气和熟石灰为原料制取漂白粉的化学反应方程式: 。
30、(8分)根据要求写方程式:
氢氧化钠没有密封保存而变质:
实验室制二氧化碳的反应原理:
曾青得铁则化为铜:
配制农药波尔多液时发生的反应:
三、实验题:(共16分)
31.(5分)现有一包白色固体混合物,可能由BaCl2、KNO3、CuSO4、Na2CO3、Na2SO4、NaCl等中的几种混合而成,为证明其组成,做如下实验:
(1)取一定量该固体混合物加入足量的水,充分搅拌,得到白色沉淀和无色溶液。过滤得到白色沉淀A,无色滤液B。
(2)向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解
(3)向无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀;
则:(1)该固体混合物中一定含有 ,可能含有 ;一定没有 。(用化学式填空)
(2)该混合物至少由 种物质构成,该混合物的所有可能组合有 种(填数字)
32、(2分)甲、乙两位同学分别设计下述两个实验方案,并都认为如果观察到的现象和自己设计的方案一致,即可证明溶液中含有SO42-
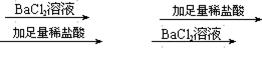 甲同学的方案:溶液
白色沉淀
沉淀不溶解
甲同学的方案:溶液
白色沉淀
沉淀不溶解
乙同学的方案:溶液 无沉淀 白色沉淀
你认为 方案合理,为什么? 。
33、(3分)有A、B、C三种溶液,已知A为钾盐,B为硝酸盐,C为碱。经下列操作,其现象分别是:①A+B→没现象 ②B+C→蓝色沉淀 ③A+C→白色沉淀(不溶于稀硝酸)用化学式填空:
A是 ;B是 ;C是 。
34、(6分)已知明矾的化学式为[KAl(SO4)2·12H2O]是农村常用的一种净水剂,它在水中能解离出自由移动的K+ 、Al3+ 、SO42-,甲同学为了探究明矾中哪种离子具有净水作用,设计了如下探究实验,请填写下表中的空白:
| 实验步骤 | 实验现象 | 结论 |
| 在一杯浑浊的水中加少量氯化钾,搅拌后静置 | 烧杯中的水仍然浑浊 | |
| 在一杯浑浊的水中加少量硫酸铝,搅拌后静置 | 烧杯中的水变澄清 | |
| 在一杯浑浊的水中加少量氯化铝,搅拌后静置 | 氯化铝能净水 |
根据上述实验方案你认为明矾中有净水作用的离子是 (写符号)
乙同学看到甲的方案后,认为该方案还不完善,他对甲同学的方案进行了补充完善。请你把乙同学补充的方案中要达到的目的和所使用的试剂填入下表:
| 实验目的 | 使用的试剂 |
四、计算题(6分)
35、要中和500Kg含49g硫酸的工业废水,需要多少克烧碱?如果用含氢氧化钠2%的废碱液来中和,则需要多少千克废碱液?(3分)
36.
在镁粉和![]() 组成的混和物中,加入足量的盐酸,并把产生的2.3克气体通入足量的澄清石灰水中,得到5克沉淀,计算混和物中镁的质量分数?(3分)
组成的混和物中,加入足量的盐酸,并把产生的2.3克气体通入足量的澄清石灰水中,得到5克沉淀,计算混和物中镁的质量分数?(3分)
05-06学年第二学期第一次模拟考试
初三化学试卷答案:
一、单项选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | D | C | C | C | C | C | B | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | B | A | D | D | C | B | B | A | D |
二、填空题(化学方程式每空2分,共38分)
21.填表题(种类:酸、碱、盐、氧化物)4分
| 物质名称 | 氢氧化铁 | 碳酸氢钠 | 氢硫酸 | 干冰 |
| 化学式 | Fe(OH)3 | NaHCO3 | H2S | CO2 |
| 种类 | 碱 | 盐 | 酸 | 氧化物 |
22、(4分)(1)(2)(3)(4)
23、(5分)酸,红,红,H+,硫酸氢钠。
24. (4分)酸,水,玻璃棒,热量。
25、(2分)Ca(OH)2、H2SO4
26、(2分)酚酞试液,变红色。
27、(4分)(1)“<”(2)“是”(3)SO2溶于水生成酸。碱溶液。
28、(3分)Fe2O3;黄色,气泡。
29、(2分)2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
30、(8分)略
三、实验题:(共16分)
31.(1)BaCl2、Na2CO3、Na2SO4,KNO3、NaCl。(2)3,4.
32、乙同学,甲同学没有排除银离子的干扰。
33、(3分)A是K2SO4;B是Cu(NO3)2 ;C是Ba(OH)2
34、(6分)氯化钾不能净水, 硫酸铝能净水, 烧杯中的水变澄清,Al3+,检验硫酸根能否净水,用硫酸钠(只要含可溶性硫酸根).
四、计算题(6分)
35、(3分)40g,2Kg 36、(3分)18.5%