扬州市初中毕业升学统一考试化学科研测试试题
(考试时间:90分钟 满分:100分)
| 题号 | 第Ⅰ卷 | 第Ⅱ卷 | 合计 | ||
| 三 | 四 | 五 | |||
| 得分 | |||||
你可能用到的相对原子质量: C:12 O:16 Na:23 CL:35.5 Ca:40 Ag:108
第Ⅰ卷(选择题 共40分)
第Ⅰ卷一、二两大项选择题的答案必须填在答题卡上,写在其它地方的不得分。
一.单项选择(共15小题,每小题2分,共30分,每小题只有一个选项符合题意)
1.小明在家准备炒菜时,将少量食用油在锅内加热温度过高,突然着火燃烧。此时,最合适的措施是:
A.立即向锅内浇水 B.熄灭火源,立即用锅盖盖严
C.立即用泡沫灭火器灭火 D.立即向锅内加入洗净切好的蔬菜
2.“白醋”是食用醋之一,它是醋酸的稀溶液,小强准备在家中用实验的方法验证“白醋”具有酸的性质。请你猜测:他选择的下列物质中,可能跟“白醋”发生反应的是:
A.食盐 B.纯碱 C.木炭 D.铜丝
3. 下列物质属于纯净物的是:
A.“光明”纯牛奶 B.“七星岩”岩石
C.“珠江”啤酒 D.“飘雪”蒸馏水
4. 以下关于燃烧现象的描述,不正确的是:
A.红磷燃烧会产生大量白烟 B.铁丝在氧气中燃烧火星四射
C.木炭在空气中燃烧产生明亮的火焰 D.镁带在空气中燃烧发出耀眼白光
5. 以下生活、学习经验,不能说明分子间有空隙的是:
A.打气筒将气体压缩 B.酒精和水混合后,总体积变小
C. 物体有热胀冷缩的现象 D.海绵能吸水
6. 如右图实验,放置1—2周时间后,装置中可能出现的现象是:
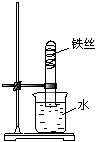
A.铁丝不变化 B.试管中的液面不变化
C.铁丝逐渐消失 D.试管中的液面上升
7. 甲、乙、丙是酸或碱的水溶液,PH分别为0、5、14。下列图形合理的是:
A.甲中滴入乙 B.水中滴入丙 C.丙中滴入乙 D.乙中滴入丙

8. 配制一定溶质质量分数的NaOH溶液时,造成所配制溶液的溶质质量分数偏高的原因可能是:
A.所用NaOH已潮解
B.用带游码的托盘天平称量NaOH质量时,误将砝码放在左盘,被称量物放在右盘
C.托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH放在纸上称量
D.用量筒量取水时,俯视水面和刻度线来读取体积读数
9.根据化学方程式4NH3+5O2====4X+6H2O,可推断X的化学式是:
A.NO B.NO2 C.N2O3 D.NH3
10.科学实验测定,正常情况下人类头发的化学组成为:45%的碳、28%的氧、15%的氮、7%的氢和5%的硫等。这里的碳、氧、氮、氢、硫泛指:
A.元素 B.单质 C.原子 D. 分子
11.若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则:
A.溶液的质量一定变小 B.溶液中溶质量分数一定变大
C.溶液的质量一定变大 D.溶液中溶质的质量分数可能不变
12.重铬酸钾(K2Cr2O7)中铬(Cr)的化合价为:
A.+3 B.+5 C.+6 D.+7
13.下列物质不属于单质的是:
A.水 B.镁带 C.硫粉 D.氢气
14.氧气和乙炔(乙炔是一种可燃性气体)用于气焊,所利用的氧气的性质是:
A.可燃性 B.支持燃烧 C.密度比空气大 C.难溶于水
15.下列实验操作中,正确的是:
A.胶头滴管用完后,将其横放在桌面上,以免试液流出
B.加热时,试管中盛液量不宜超过其容积的2/3
C.用剩的药品一定要放回原瓶,以免浪费
D.将试管夹从试管底部望上套,夹在试管中上部
二、不定项选择(共5小题,每小题2分,共10分,每小题有1—2个选项符合题意。错选、多选均不给分,漏选给1分)
16.右图为M、N两种物质在饱和溶液中溶质的质最分
数(a%)随温度(t℃)变化的曲线,现将50gM物质、
80gN物质分别溶于150g水中并同时加热,分别蒸
发掉50g水,冷却到t℃。下列说法正确的是〔溶
液加热时,M、N不挥发也不发生反应〕:
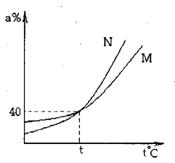
A.M、N都从溶液中析出
B.只有N从溶液中析出
C.M的溶液为饱和溶液
D.N的溶液为不饱和溶液
17.某氢氧化钠溶液中,Na+离子与H原子的个数比为1:41,则该溶液中溶质的质量分数是:
A 5.1% B 9.8% C 10% D 69%
18.某在空气中暴露过的KOH固体,经分析知其中含H2O7.62%,K2CO32.38%,KOH90%。若将此样品W克加入到98克20%的稀硫酸中,过量的酸再用20克10%的KOH溶液中和,恰好完全反应。将中和后的溶液蒸发,可得到的固体质量是:
A 30.8g B 34.8g C 30.8~34.8之间 D无法计算
19.在已调平的天平两端各放一个等质量的烧杯,向烧杯中各注入质量相等、溶质质量分数也相等的足量稀硫酸。在左边烧杯中投入一定质量的金属X粉末,同时在右边烧杯中投入与X等质量的金属Y粉末。观察到天平的指针先偏向左边,当两种金属完全溶解后,天平的指针偏向右边。则X、Y是下表组合中的:
| A | B | C | D | |
| X | Mg | Zn | Zn | Fe |
| Y | Fe | Mg | Fe | Zn |
20.以下验证“盐酸中哪种粒子使紫色石蕊试液变红色”的实验设计不合理的是:
A.
B.
C.
D.
第Ⅱ卷(非选择题 共60分)
三、填空(除有说明的外,每空1分,共18分)
21.根据下列要求用化学符号表示:
①4个碳酸根离子 ② 3个二氧化氮分子
③三氧化二铁中铁的化合价为+3价 ④石灰石的主要成份
⑤人体中含量最多的物质 ⑥生铁中含量最多的元素
⑦铁和稀硫酸恰好完全反应后所得溶液中的溶质
22.(4分)向pH=0的A溶液中加入几滴酚酞试液后振荡,溶液呈 色。要使上述混合溶液颜色发生改变.可向其中加入 溶液,用A溶液判断铝和铜金属活动性顺序的操作方法是 。
23.(4分)用某种催化剂处理汽车尾气中的CO与NO,可以使之转化为两种无毒气体,其中一种可参与绿色植物的光合作用,另一种是空气中体积分数最大的气体。这两种气体是 、 (写化学式),该反应的化学方程式为: 。
24.右图是 A、B 两种固体物质的溶解度曲线,判断下列说法的正误(正确打ü 错误打×) 。
(1)10℃时,B 的溶解度大于 A 的溶解度 …………( )
(2)15℃时,A、B的饱和溶液的溶质质量分数相等 ( )
(3)20℃时,将10 gA 固体投入 25g水中,可得到35 g溶液 ( )
四、分析说明(除有说明的外,每空1分,共18分)
25.(4分)镁是一种很活泼的金属,点燃后,它既能在氮气中燃烧,也能在二氧化碳中继续燃烧。已知镁在氮气中燃烧生成氮化镁(Mg3N2),镁在二氧化碳中燃烧生成黑色炭粒和一种金属氧化物,试写出上述两个反应的化学方程式:
, 。
26.(3分)现有一瓶未知气体,已知由初中化学中常见的2或3种气体组成。经检验只含C、O两种元素,且C、O两种元素质量比为3︰5,则该气体的可能组成有:
(1) (2) (3)
(4) (有几组写几组,可以不写满,也可以补充)
27.在炎热的夏天,人们常要喝“百事可乐”、“健力宝”等饮料,饮料中含有碳酸。当打开饮料瓶盖时,会有大量气泡冒出,且饮料常会溢出瓶外。冒出的这种气体可能是 (填化学式)。这表明气体的溶解度与 有关。人喝了后会打嗝,这说明气体的溶解度还与 有关。
28.质量比为7:3的铁和镁的混合物8克与100克盐酸反应。
(1)(2分)试分析:欲求生成H2的质量时,还需要什么数据?
答: 。
(2)写出下列情况下上述所需数据的取值范围,并求出该情况下生成氢气的质量,分别填入下表(已知通常状况下,浓盐酸最大溶质质量分数为38%):
| 所需数据(用a表示)的取值范围 | 生成氢气的质量/克 | |
| 盐酸不足时 | a | |
| 盐酸足量时 | a |
五、综合探究(除有说明的外,每空1分,共24分)
29.根据下列装置图填空:

(1)写出编号①、②仪器的名称:①________________;②________________。
(2)实验室制取二氧化碳的发生装置应选用___________(填序号,下同),收集装置应选用___________;若在实验室用加热高锰酸钾的方法制取氧气,发生装置应选用_____(实验时应在试管口放一团 ),收集装置可选用 或 。
(3)由此我们得到启示:
实验室选择气体发生装置时,应考虑________________和 _;
选择气体收集装置时,应考虑 和 _________。
30.某中和反应需要100克10%的KOH溶液。
(3分)需多少克质量分数为20%的稀硫酸才能将100克10%的KOH溶液恰好完全中和?
(4分)提供如图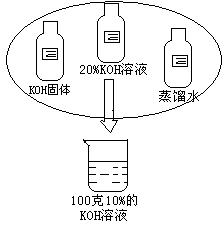
所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中。
| 序号 | 配制100克10%的KOH溶液 |
| 方案1 | |
| 方案2 |
31.测量一块一定质量的铁锌合金与稀盐酸反应产生的氢气的体积,可求得合金中铁及锌的质量分数(设合金样品全部反应,产生的气体不超过100mL)。现有下列实验用品(只允许使用以下仪器):800mL烧杯、100mL量筒、玻璃棒、短颈玻璃漏斗、铁架台(带铁夹)、已称量过的铁锌合金样品、浓盐酸和足量的水。
(1)(2分)画出你所设计的实验装置的示意图:
(2)(3分)简要说明实验步骤:
。