初中化学模拟试题(五)
(120分钟)(100分)
一、选择题:(下列各题只有一个正确答案,共30分)
1.下列变化中,属于化学变化的是 [ ]
A.干冰变成二氧化碳气
B.从空气中分离出氧气
C.蓝矾受热变成白色粉末
D.海水经日晒后可析出食盐晶体
2.构成物质的微粒有①元素②原子③离子④质子⑤分子 [ ]
A.只有① B.只有③ C.②③⑤ D.以上都可以
3.下列符号中能表示两个氢分子的是 [ ]
![]()
4.下列各组变化中,后者一定包括前者的是 [ ]
A.化学变化、物理变化 B.还原反应、置换反应
C.氧化反应、化合反应 D.中和反应、复分解反应
5.下列关于溶液的说法中正确的是 [ ]
A.同种溶质的饱和溶液一定比不饱和溶液的浓度大
B.在某物质的饱和溶液里加入其他任何物质都不能溶解
C.某物质的饱和溶液,当升高温度时,若溶液的质量不变,则溶液的
浓度也不变。
D.溶液中阳离子总数一定等于阴离子总数
6.下列说法中错误的是 [ ]
A.溶液中的溶质可以是固体,也可以是液体或气体
![]()
C.饱和溶液一定是浓溶液
D.氧化剂具有氧化性
7.下列属于混合物的是 [ ]
![]()
B.含铜80%的氧化铜
C.纯净的稀硫酸
D.氯酸钾充分加热后剩余的固体
8.有盐酸、液态氢、二氧化碳、熟石灰四种物质,它们的有关用途是①
建筑材料、②灭火、③火箭燃料、④金属表面除锈。按上述四种物质
排列顺序,它们相应的用途正确的是 [ ]
A.①②③④ B.④③②① C.③④①② D.④③①②
9.若A、B、C为三种金属,根据下列化学反应,推断A、B、C三
种金属的活动顺序为
![]()
![]()
![]()
A.A>B>C B.A>C>B C.B>C>A D.C>A>B
![]()
![]()
11.在化学反应X+Y=Z中5克X和足量的Y充分反应生成B克
Z。则参加反应的Y是 [ ]
A.8克 B.5克 C.3克 D.2克
12.下列每组物质的名称、俗称、化学式三者不能表示同一种物质的是
[ ]
A.氯化钠、食盐、NaCl
B.氯化氢、盐酸、HCl
![]()
13.根据下列微粒结构示意图,哪种说法是不正确的
[ ]
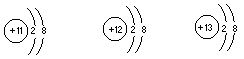
A.它们都带有电荷 B.它们的核外电子排布相同
C.它们都具有稳定结构 D.它们表示同一种元素
14.某金属元素,它的氢氧化物的式量为m,它的氯化物的式量为n,
则该金属元素的化合价为 [ ]
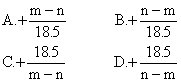
![]()
则该酸能生成的酸式盐可能有 [ ]
A.n种 B.2n种 C.n-1种 D.n+1种
16.下列各组物质混合后,溶液质量不发生改变的是
[ ]
A.氢氧化钾溶液和盐酸 B.氯化钡溶液和稀硫酸
C.碳酸钠溶液和盐酸 D.铜和硝酸汞溶液
17.下列的实验设计,可行的是 [ ]
![]()
B.往铜盐溶液中加入银以获得少量铜
C.将二氧化碳、氧气混合气通入盛有灼热铜的试管,以除去二氧化碳气
D.用稀盐酸除去混在铜粉中的镁粉和铝粉
18.根据化学方程式
![]()
![]()
的活动性由大到小的顺序是 [ ]
A.Ni、Cu、Ag B.Cu、Ag、Ni
C.Ag、Cu、Ni D.Ag、Ni、Cu
19.从200克浓度为10%的氢氧化钠溶液中倒出20克,剩下溶液的百
分比浓度为 [ ]
A.9% B.10% C.11% D.20%
20.点燃3体积氢气与2体积氧气的混合物,剩余的气体是 [ ]
A.0.5体积氧气 B.1体积氧气
C.1体积氢气 D.氢气、氧气各1体积
21.在20℃时,把24克A物质放入75克水中,完全溶解后溶液恰好达
到饱和。则该温度下A物质的溶解度是 [ ]
A.24克 B.24 C.32 D.32克
22.在M克食盐溶液中含有食盐m克,则溶液的质量百分比浓度是 [ ]
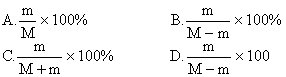
23.一定温度下,某物质饱和溶液的质量百分比浓度为n%,此温度下
该物质的溶解度为 [ ]

24.60℃时硝酸钾的溶解度为110克。60℃时将60.0克硝酸钾放入
50.0克中,充分溶解后,所得溶液的质量百分比浓度为 [ ]
A.54.6% B.52.4% C.50% D.60%
25.下列溶液中,百分比浓度最大的是 [ ]
A.某温度下,溶解度为20克的某物质的饱和溶液
B.20克溶质溶解在一定量水里配成100毫升溶液,此溶液密度为
![]()
C.100克20%的某溶液,加水稀释到200克
D.100克10%的某溶液,再溶解10克该溶质
26.将一瓶稀盐酸分成4等份,分别跟适量的下列物质反应(均恰好反
应完全),所得氯化锌溶液的百分比浓度最大的是 [ ]
A.锌 B.氧化锌 C.氢氧化锌 D.碳酸锌
![]()
合气体在氧气中充分燃烧后,将产生的气态物质依次通过浓硫酸和氢
氧化钠溶液,发现浓硫酸和氢氧化钠溶液的质量都有增加。则该混合
气体的组成不可能是 [ ]
![]()
28.向碳酸钠溶液中加入适量甲溶液,产生白色沉淀;向该白色沉淀中
加入适量乙溶液,沉淀完全溶解,产生气泡同时得到溶液丙;向丙溶
液中加入丁溶液,又产生白色沉淀。则甲、乙、丙、丁4种溶质依次
是 [ ]
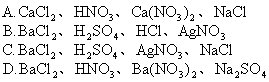
![]()
好完全反应,则该稀硫酸的质量百分比浓度是 [ ]
A.10% B.16% C.18.4% D.19.6%
![]()
11:5:1,用电火花点燃反应后,冷却至室温,容器内所得溶液
的百分比浓度为 [ ]
A.40.56% B.28.85% C.20.28% D.16.67%
二、选择题:(下列各题有1─2个答案,共10分)
1.下面关于分子的说法中,错误的是 [ ]
A.分子是保持物质化学性质的一种微粒
B.分子在不停地运动着,分子间有一定的间隔
C.物质都是由分子构成的
D.分子是化学变化中的最小微粒
2.下列物质中加点元素的化合价相等的组是 [ ]
![]()
A.④⑤ B.①③ C.②④ D.①⑤
3.某氮的氧化物中,氮、氧元素的质量比为7:16,该化合物的化学
式是 [ ]
![]()
4.下列说法中正确的是 [ ]
A.酚酞能使碱溶液变红
B.在通常温度下,pH值小于6的溶液显酸性
C.阳离子的核电荷数一定大于核外电子数
D.碳酸盐都易溶于水
5.下列各组物质滴入酚酞试液后,溶液显红色的是
[ ]
A.氧化铁加水
B.氧化钡加水
C.10克20%的盐酸和20克10%的氢氧化钾溶液
D.10克20%的硫酸和20克10%的氢氧化钠溶液
6.既能和氢氧化钙反应又能和盐酸反应的是 [ ]
A.氯化铁 B.碳酸钾 C.硝酸银 D.硫酸钠
![]() [
]
[
]
A.铂粉 B.NaOH溶液 C.铁粉 D.锌粉
![]()
且溶液中残留有不溶物。试分析在碳酸钙样品中,关于①碳酸镁,②
碳酸钾,③二氧化硅等杂质含有的情况,结论正确的是 [ ]
A.肯定含①和③,肯定不含②
B.肯定含①和③,可能含②
C.肯定含②和③,肯定不含①
D.肯定含②和③,可能含①
9.在一定条件下,12克碳和16克氧气在密闭容器中充分反应后,容器
内存在的是 [ ]
![]()
10.用含杂质(杂质不与酸反应)的铁10克与50克稀硫酸充分反应,
铁消耗完。滤去杂质,溶液的质量为55.4克。此铁的纯度是 [ ]
A.无法确定 B.84% C.28% D.56%
三、填空题(共26分)
1.用H、C、O、Na四种元素,从中选出合适的元素,写出符合下
列要求的一种物质化学式:酸________、碱________、酸式盐
______、正盐________、碱性氧化物________。
2.在①稀硫酸②氯化铜溶液③氯化钠溶液中,分别放入足量铁粉,经过
一定时间后,溶液浓度增大的是(写序号,下同)________、浓度减
少的是________、浓度不变的是________。
3.实验室有一瓶敞口放置的熟石灰,取出少量加入盐酸,看到有少量气
泡产生,其原因是__________________________________________。
有关化学方程式是__________________________________________。
4.下图是甲、乙、丙三种固体物质的溶解度曲线图。
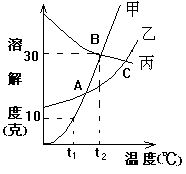
①曲线上能表示某温度下乙、丙两种物质溶解度相等的点是________。
②如果甲物质中混有少量的乙物质,可用________法提纯甲物质。
![]()
5.有A、B、C、D、E、F6种物质,可发生如下反应。已知B为盐酸,试分析推断出它们各是什么物质,写出化学式。
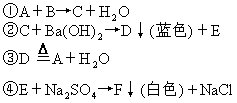
可知A为________,C为________,D为________,E为________,
F为________
6.根据下面的叙述,写出化学方程式:
(1)高能、低污染的新型燃料在空气中燃烧
(2)用常见不挥发性的二元酸除铁锈
(3)从含氧化铁的铁矿石中冶炼铁
(4)西汉时期,湿法炼铜的反应原理
(5)冶疗胃酸(含稀盐酸)过多的药品中含有氢氧化铝
(6)用消石灰等物质生产火碱
![]()

四、实验题(共19分)
1.配制50克10%的氢氧化钠溶液的步骤如下:
(1)调整天平的零点:若指针偏向右边,应将左边的螺丝向________
移动,直到指针指在标尺中央。
(2)称取5克氢氧化钠:先将_______放在左盘,再放入NaOH,在
右盘加砝码时,先加质量(填大或小)________的砝码,再加质
量________的砝码,直至称出5克氢氧化钠为止。
(3)溶解:用____________量取____________毫升水倒入盛氢氧化钠
的容器中,用____________搅拌使之溶解。

透明的溶液,加稀硝酸后沉淀部分溶解;过滤,往滤液中滴加硝酸银
溶液,又有白色沉淀生成。则原混合物中肯定存在的物质有(用化学
式表示):____________________。
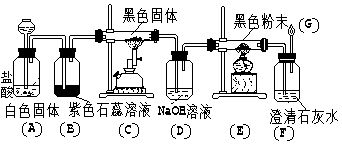
3.按下图装置进行实验,可看到下列各现象(B)中试液变红(F)中
溶液变浑浊(E)玻璃管中的粉末变红(G)处有浅蓝色火焰。
(1)写出(A)、(C)、(D)、(E)、(F)、(G)
反应的化学方程式:
(A)____________________ (C)_____________________
(B)____________________ (D)_____________________
(F)____________________ (G)_____________________
(2)从(E)和(G)处的反应,说明________具有________性和
________性
五、计算题(共15分)
![]()
溶液恰好完全反应,反应后将溶液过滤,得沉淀14.35克,将滤液蒸
发掉78.45克水,再冷却到t℃时溶液恰好饱和。求:
(1)滤出沉淀时所得溶液的质量百分比浓度。
(2)反应后所得溶液中溶质在t℃时的溶解度。
2.有两种二价活泼金属A和B,以原子个数比3∶4组成混合物33.2
克。将这33.2克混合物与足量盐酸反应,在标准状况下生成氢气
15.6升(氢气密度0.09克/升);此混合物中的A单质能与4.8克
氧气反应生成12克A的氧化物。试通过计算确定这两种金属的名
称。