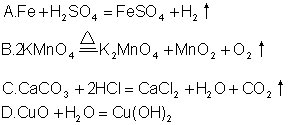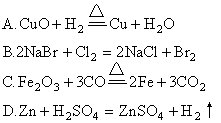中考模拟(2)
(100分120分钟)
一.选择题(只有一个正确答案)
| 1. |
|
| 2. | 下列变化前者是物理变化,后者是化学变化的是 [ ] |
| 3. | 下列物质:①氧化镁②液态氧③石灰石④水煤气⑤二氧化碳⑥高锰酸钾加热制取氧气后的剩余物属于混合物的是 [ ] |
| 4. | 下列物质的化学式与名称或俗名不表示同一物质的是 [ ] |
| 5. | 下列化学方程式书写错误或不符合事实的是 [ ] |
| 6. | 下列各组物质与氧气发生反应都不属于化合反应的是 [ ] A.甲烷、蜡烛 B.铁、甲烷 C.硫、蜡烛 D.铁、硫 |
| 7. | 下列化合物中,氮元素只表现+5价的是 [ ] |
| 8. | 下列各组物质的转化不能通过一步反应实现的是 [ ] |
| 9. | 有关饱和溶液和不饱和溶液的叙述中正确的是 [ ] A.在一定量的溶液里,不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液. |
| 10. |
|
| 11. | 下列各组核电荷数中,能形成离子化合物的一组是 [ ] A.1和17 B.11和17 C.19和20 D.18和20 |
| 12. | 下列哪个不是置换反应 [ ] |
| 13. | 下列哪组气体既有可燃性又有还原性 [ ] |
| 14. | 等质量的二氧化硫和三氧化硫,它们二者含氧元素的质量比是 [ ] A.1:2 B.3:4 C.5:6 D.2:3 |
| 15. | 要洗掉盛放石灰水的试剂瓶内壁上的沉积物,可选用下列试剂中的 [ ] A.稀盐酸 B.蒸馏水 C.硝酸银溶液 D.烧碱溶液 |
| 16. | t℃时,用10克硝酸钾可制成饱和溶液40克,则硝酸钾在t℃时的溶解度是[ ] |
| 17. | 分离NaCl与硝酸钾混合物的方法是 [ ] A.溶解 B.过滤 C.结晶 D.蒸发 |
| 18. | 下列物质的水溶液不能导电的是 [ ] A.食盐 B.氢氧化钠 C.蔗糖 D.硝酸钾 |
| 19. | 能和NaOH共存于水中的物质是 [ ] A.硝酸钾 B.硫酸 C.二氧化碳 D.硝酸铜 |
| 20. |
|
| 21. | 某温度时,某物质的溶解度是a克,它的质量百分比浓度为b%,则a与b在数值上的关系是 [ ] A.a=b B.a>b C.a<b D.无法比较 |
| 22. | 下列铁的氧化物中,含铁的百分比最大的是 [ ] |
| 23. |
|
| 24. |
|
| 25. | 都能用实验室制氢气的发生器来制取的气体是 [ ] |
| 26. |
|
| 27. |
|
| 28. | 质量相等的两块金属A、B分别与适量盐酸反应,A置换出的氢气多;所得的氯化物中A、B的化合价相同,由此可知 [ ] A.A的原子量小于B |
| 29. | 有两组物质:①铝、氧化铜、澄清石灰水、硝酸银;②氧气、氯化亚铁、盐酸、硫酸铜.其中一组有一种物质能和另一组中所有物质反应,它是 [ ] A.硫酸铜 B.澄清石灰水 C.氯化亚铁 D.盐酸 |
| 30. | 下列计算结果错误的是 [ ] A.使160克氧化铜完全还原需要12克碳 |
二、选择题(每题有1-2个正确答案)
| 1. |
|
| 2. | 将下列物质长期露置于空气中,质量增加的是 [ ] A.氧化钙 B.氢氧化钠 C.浓盐酸 D.浓硝酸 |
| 3. | 下列各组中物质的水溶液相互混合后,没有沉淀生成的是 [ ] |
| 4. | 有a、b、c三种金属,将a和b分别浸入稀硫酸中,b反应生成氢气,a不反应,将a浸入c的硫酸盐溶液中,在a的表面有c析出a、b、c三种金属的活动性顺序为[ ] A.b>H>a>c B.c>b>H>a |
| 5. | 要除去二氧化碳中混有的少量CO,最好是将混合气体 [ ] A.通过水 B.通过加热氧化铜 |
| 6. |
|
| 7. | 既能用向下排空气法收集,又能用排水法收集的气体是 [ ] |
| 8. | 下列实验操作中,正确的是 [ ] A.制氧气完毕,先灭酒精灯后撤导气管 |
| 9. | 下列物质中,既不溶于水,又不跟稀硫酸反应,却能跟硝酸银溶液反应的是[ ] A.氯化钠 B.碳酸钡 C.锌 D.铜 |
| 10. | 有甲、乙、丙三种物质的溶液,甲与硫酸钾溶液反应,乙与氯化钾溶液反应,丙与氢氧化钾溶液反应均可生成硝酸钾,那么甲、乙、丙应是 [ ] 甲 乙 丙 |
三、填空:
1.在下列实验:①加热碱式碳酸铜②点燃镁条③在氧气中点燃细铁丝④
氢气通入灼热的氧化铜⑤点燃红磷⑥高温加热碳酸钙中,化合反应
有_______(写序号,下同)分解反应有_______、置换反应有_______、
生成物中有白色固体的有______、生成物中有黑色固体的有______、
生成物有二种物质的是______、反应物为暗红色的是______、生成物
中有亮红色的是_______
2.分子是________微粒;元素是_________的总称.
3.检验集气瓶中是否盛有氧气,应_________;检验瓶中二氧化碳是否已
经集满应___________
4.在NaOH中的原子团是________,它显_______价;在硫酸铝中,各
元素正负化合价的代数和为__________.
5.某元素的原子结构示意图为
![]()
该原子核电荷数为_____,核外共有_______个电子,最外层电子数为
________.
6.水在________电的作用下,负极生成________气,正极生成_______气,
两种气体的质量比为_________.
7.钠与氯气反应时,每个钠原子_________电子,成为_________(阴、阳)
离子;每个氯原子_________电子;它们生成的化合物为_________化合物. 8.相同质量的高锰酸钾和氯酸钾,含氧质量__________多,它们分别完全
分解,生成的氧气________多.
9.某物质完全燃烧生成二氧化碳和水,该物质的组成中一定含有______
元素,可能含有___________元素.
10.使含6克A、6克B、8克C的固体混合物充分反应后,得到的物质
中,没有A、C;有15克B和若干克气体D,则反应前后各物质的质量
比为A:B:C:D= : : :
四、简答题:
1.配平或完成下列化学方程式,在( )内注明反应类型(写反应的基本类
型,如不属于基本类型,则写其它类型)
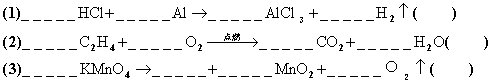
(4)一氧化碳在空气中燃烧_______________( )
2.无色气体A通入灼热的黑色固体B中,得到一种气体C;将C通入另一
种黑色固体D中,加热又得到A和一种红色金属;A通入水中得到E,E
能使紫色石蕊试液变红.有关物质的名称是:A________、
B_________、C________、D________、E_______
A与B反应的化学方程式______________
A与水反应的化学方程式______________
3.用最简明的语言回答:氯酸钾中加入少量高锰酸钾加热,能否迅速分解,
为什么?该实验中高锰酸钾是不是催化剂,为什么?
4.根据下图所画实验装置,回答问题
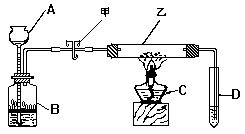
(1)图中仪器的名称是A_______、B_______、C________、D________
(2)玻璃管乙中,盛放的是碱式碳酸铜.先用止水夹甲夹紧胶皮管,然后
用C充分加热乙管,碱式碳酸铜由____色变为____色,在玻璃管右侧
![]()
_________________D中盛有澄清的石灰水,现象是________,所发生
反应的化学方程式是______________.
(3)A中盛有稀硫酸,B中隔板上放有锌粒,碱式碳酸铜分解完毕后,打开
止水夹甲,并继续使用C加热玻璃管乙,B中看到的现象是,有____生
成,化学方程式为_______,乙中看到的现象是________,化学方程式
为_______.
五、计算题
![]()
![]()
2.将铁片放入硫酸铜溶液中片刻,取出铁片、洗净、烘干、称量,知铁
片质量增加0.4克(假定析出的铜没有脱落),问用去多少克硫酸铜?生
成多少克铜?
3.将一块质量为7.5克表面蒙有氧化物的锌片,放入浓度为30%的稀硫
酸中,充分反应后得到的气体恰好与7.95克的一种不溶于水的黑色粉
末完全反应,得到一种不与盐酸反应的红色金属,求此锌片的纯度.