第一学期期末试题(二)
(90分钟100分)
一、选择题(共40分,下列各题有一个或二个正确答案)
![]() [ ]
[ ]
A.两个氢原子 B.两个氢元素
C.两个氢离子 D.两个氢分子
2. 8克氢气和8克氧气完全反应生成水的质量是: [ ]
A.16克 B.12克 C.8克 D.9克
3.某反应x+y=M+N;若生成10克M的物质,需要用15克
x物质和25克y物质,现生成10克N物质时,参加反应的x物
质的质量是: [ ]
A.5克 B.10克 C.15克 D.20克
4.某元素的原子核外M(第三)层电子数是L(第二)层的
0.25倍,该元素的离子结构示意图为: [ ]

5.下列物质中,氮元素的化合价由低到高的顺序排列的是: [ ]
![]() 、
、
![]() 、
、
![]() 、
、
![]()
![]() 、
、
![]() 、
、
![]() 、
、
![]()
![]() 、
、
![]() 、
、
![]() 、
、
![]()
![]() 、
、
![]() 、
、
![]() 、
、
![]()
6.某元素的原子量为70,它的氧化物中R元素和氧元素的质量比为
35∶12,则R的化合价是: [ ]
A.+1 B.+2 C.+3 D.+4
![]() [ ]
[ ]
![]()
![]()
![]()
![]()
8. x、y两种元素的原子量分别为m和n,化合价分别为+a、-b,
则由两元素组成化合物中x元素与y元素的质量比是: [ ]
A.am:bn B.an:bm C.bm:an D.bn:am
9.某二价金属的难溶性碱a克,受热分解后得到b克金属氧化物,
则金属氧化物的式量是: [ ]
![]()
![]()
![]()
![]()
10.下列含氮化物中,氮元素化合价的代数和等于零的是: [ ]
![]()
![]()
![]()
![]()
11.下列物质属于纯净物的是: [ ]
A.大理石 B.干冰 C.稀硫酸 D.水煤气
12.下列各物质不能用作还原剂的是: [ ]
A.木炭 B.一氧化碳 C.二氧化碳 D.氢气
13.下列各反应需要加还原剂并加热才能实现的是: [ ]
A.氧化镁→氢氧化镁 B.铁→四氧化三铁
C.二氧化碳→一氧化碳 D.氯化铜→氢氧化铜
14.长期放置在空气中会变质并发生氧化反应的是: [ ]
A.生石灰 B.白磷 C.烧碱 D.粗盐
15.不能生成大量二氧化碳的反应是: [ ]
A.碳酸钠与稀硫酸 B.碳酸镁与盐酸
C.碳酸钙与盐酸 D.碳酸钙与稀硫酸
16.下列反应产物不污染环境的是: [ ]
A.硫在空气中燃烧 B.碳的不完全燃烧
C.氢气在空气中燃烧 D.磷在空气中燃烧
17.下列各组物质中,前一种是单质,后一种是化合物的是: [ ]
A.硫酸、硫粉 B.氨、氨水
C.液氧、苛性钠 D.干冰、冰
18.属于分子和原子区别正确的是: [ ]
A.分子比原子大
B.原子比分子重
C.分子运动,原子不运动
D.在化学反应中,分子可分,原子不可分
![]() [ ]
[ ]
![]()
![]()
![]()
![]()
![]() [ ]
[ ]
A.都含有氧元素 B.都含有氧气
C.都属于氧化物 D.都含有相同价数的氧元素
21.下列物质发生反应不能得到白色固体的是: [ ]
A.钠在氯气中燃烧 B.磷在氧气中燃烧
C.镁在空气中燃烧 D.氢气在氯气中燃烧
22.加热氯酸钾时,不加入二氧化锰则: [ ]
A.不产生氧气
B.产生氧气的速度较慢
C.生成的氧气量减少反应速度减慢
D.反应停止
23.下列变化中,氢元素由化合物变为单质的是: [ ]
A.锌与稀硫酸反应 B.氢气还原氧化铜
C.氢气在氯气中燃烧 D.液态氢变成氢气
24.某气体在实验室制取时,既可用排水法收集,又可用向上排空气法收
集,某气体的性质是: [ ]
A.易溶于水比空气密度小
B.能溶于水比空气密度大
C.难溶于水比空气密度大
D.不溶于水比空气密度小
25.某碳的氧化物,碳元素与氧元素的质量比为3:4,下列关于该碳的氧
化物叙述正确的是: [ ]
A.碳与氧的原子个数比是1:1
B.碳与氧元素的质量比为1:1
C.碳与氧的原子个数比是1:2
D.氧的百分含量为57.14%
26.对于“具有相同质子数的微粒”下列叙述正确的是: [ ]
A.一定具有相同的电子数
B.一定是同种元素
C.不一定是同种元素组成的微粒
D.可能是单质,也可能是化合物
27.在一定条件下,托盘天平的两盘上各放一盛有等浓度、等体
积稀硫酸的烧杯,天平呈平衡状态,若在两稀硫酸中分别放
入下列物质,反应完全后天平仍保持平衡的是: [ ]
A.分别放入等质量的铝、锌,两金属完全溶解
B.分别放入等质量的镁、铝,反应后两金属都有剩余
C.分别放入等质量的锌、铜
D.分别放入56克铁、27克铝,且两金属都溶解
28.下列气体在氧气中燃烧后,将其生成物依次通过浓硫酸和固体
氢氧化钠后,测得浓硫酸和氢氧化钠都增重,增重的质量比为
9∶11,则该气体是: [ ]
A.氢气 B.一氧化碳 C.乙炔 D.甲烷
29.要除去二氧化碳中混杂的氯化氢气,应使气体通过 [ ]
A.石灰水 B.浓硫酸
C.烧碱溶液 D.碳酸氢钠溶液
30.测知CO跟气体M的混合气中,氧元素的百分含量为55%,
则该气体M是: [ ]
![]()
![]()
![]()
![]()
31.在化学反应M+N=P+Q中,下列说法正确的是 [ ]
A.若M、P是单质,N、Q是化合物,则该反应不一定是置换反应
B.若P、Q是盐和水则该反应不一定是中和反应
C.若取M、N各a克,则反应生成的P、Q总质量不一定是2a克
D.反应物M和N的质量比一定等于生成P和Q的质量比
32.用镁和铝分别与稀硫酸反应,若各制得m克氢气,需要用去镁和铝
的质量比是: [ ]
A.1∶3 B.3∶1 C.4∶3 D.8∶9
二、填空题(共40分)
1.在氧气、氢气和稀硫酸三种物质中,可用来急救病人的是__________
____________;可用来金属除锈的是_______________;可用来充灌气
球的是______________.
2.将含有一氧化碳、氯化氢和氮气的混合气体先通过足量的氢氧化钙溶
液,充分反应后剩余_______________气体,再通过足量的灼热氧化铁,
充分反应后还有____________气体.
3.有A、B、C、D、E五种元素,A元素原子核外K(第一)层与M
(第三)层上电子数相等;B元素的单质在氧气中燃烧发出明亮的蓝紫
色火焰,并产生有剌激性气味的气体;E的单质在C的单质中燃烧,发
![]()
11个质子,写出A、B、C、D、E五种元素的符号
A__________B__________C_________D__________E___________.
![]()
为_______________.a克二价金属B与稀硫酸完全反应生成b克氢气,
B的原子量为______________.
5.根据下列发生的反应,确定A、B、C、D、E五种物质的化学式
![]()
![]()
![]()
A__________,B_________,C________,D_____________,E_________.
6.
![]()

![]()
![]()
被氧化_________________是氧化剂。
8.写出下列各化学方程式
(1)有三种化合物生成的分解反应:
______________________________________________________________
(2)有一种单质和一种化合物参加的化合反应
___________________________________________________________
(3)实验室制氢气的反应
______________________________________________________________
![]()
______________________________________________________________
(5)灼热的氧化铜与氨反应生成铜、氮气和水
______________________________________________________________
三、实验题(共10分)
根据实验室制氧气的装置图, 回答下列问题:
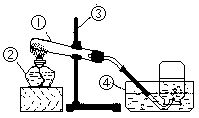
1.写出图中所示编号的仪号名称:
①_____________②___________③_______________④____________
2.写出试管中所起反应的化学方程式:
______________________________________________________________
3.二氧化锰在这反应中起______________作用
4.气体收集满后,停止加热时先要_____________,然后_______________
5.用简单方法验证收集的气体是氧气:_____________________
6.若要从剩余固体中回收二氧化锰,需用__________________法.
四、计算题(共10分)
把盛有9.62克的氯酸钾和高锰酸钾的混合物充分加热到不再放氧
气时,试管里还剩余7.24克固体,把剩余的固体加水溶解后过滤,滤纸上
残留的固体,经干燥质量为1.30克。问:
(1)原混合物中,氯酸钾的百分含量是多少?(保留两位小数)
(2)在标准状况下放出氧气多少升?
(已知氧气的密度为1.43克/升)(保留两位小数)
(100分120分钟)
有关原子量:H─1 C─12 N─14 O─16 Mg─24
S─32 Cl─35.5 K─39 Mn─55 Cu─64 Zn─65
一、选择题:每小题均只有一个正确答案,请将正确答案的序号填在[ ]内.
| 3. | 物质发生化学变化的本质特征是 [ ] |
| 4. | 能使带火星的木条燃起火焰的是 [ ] |
| 5. | 下列物质中的硫元素,化合价最低的是 [ ] |
| 6. | 下列操作正确的是 [ ] |
| 7. | 下列气体中,只能用向上排空气法收集的是 [ ] |
| 8. | 对原子的概念,叙述正确的是 [ ] |
| 9. | 下列玻璃仪器,久盛各种试剂后,内壁附有一层污垢,不能用盐酸除去的是 [ ] |
| 10. | 下列属于纯净物的是 [ ] |
| 11. | 与元素的化学性质关系非常密切的是该元素原子的 [ ] |
| 12. | 实验室制氢气,最常选用的药品是 [ ] |
| 13. | 下列物质燃烧的产物,不污染空气的是 [ ] |
| 14. | 下列物质属于单质的是 [ ] |
| 15. | 同种元素的原子和离子都具有相同的 [ ] |
| 16. | 下列说法正确的是 [ ] |
| 17. | 空气中含量居第二位的气体与地壳中含量居第二位的金属所形成的化合物,其化学式是 [ ] |
| 18. | 下列算式或计算结果正确的是 [ ] |
| 19. |
|
| 20. | 化学式为 |
| 21. | 相同质量的两份氧化铜,一份用炭粉、一份用CO还原,则消耗的炭粉和一氧化碳的质量比为 [ ] |
| 22. | 下列各组微粒中,具有相同的电子层数和最外层电子数的是 [ ] |
| 23. | 下列溶液各20克,分别蒸发掉2克水,仍恢复到原温度时百分比浓度增大的是 [ ] |
| 24. | 要除去铜粉中混有的少量锌粉,应选用的合适试剂是 [ ] |
| 25. | 下列物质中属于混合物的是 [ ] |
| 26. | 配制一定百分比浓度硫酸溶液,实验时必不可少的一组仪器是 [ ] |
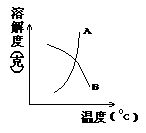
| 27. | A、B两种固体的溶解度曲线如下图所示,某烧杯中盛有含A、B两种溶质的60℃时的饱和溶液,且杯底尚有少量A、B固体,随着温度的降低,则 [ ] |
| 28. | 下列物质分别和36.5克20%的盐酸恰好完全反应,其中能使所得溶液浓度最小的是 [ ] |
| 29. |
|
| 30. | 氢气、一氧化碳、木炭粉分别与黑色氧化铜粉末反应时,下列叙述中不正确的是 [ ] |
二、选择题(下列题有1─2个正确答案)
1.已知元素X的化合价为+3价,下列化学式中正确的是 [ ]
![]()
2.下列盐中,不能直接用盐酸跟金属反应来制取的是
[ ]
![]()
3.当一种元素的原子变为离子时,这种原子发生的变化是 [ ]
A.失去电子
B.得到电子
C.既可得到电子,也可能失去电子
D.既不得到电子,也不失去电子
4.现有一定温度的氯化铵饱和溶液200克,欲改变此溶液的质量百分比浓度,可采用的方法是[ ]
A.温度不变,蒸发掉20克水
B.温度不变,加入10克氯化铵固体
C.温度不变,取出10克原溶液
D.温度不变,加入20克水
5.在一定温度下,A克水中溶解了B克某物质形成饱和溶液,此物质在该温度时的溶解度是 [ ]
![]()
6.将一定质量的碳酸钙和Cu粉置于同一敞口容器中,加热煅烧使其完全反应,反应前后容器内固体的质量不变,则容器中的Cu和碳酸钙的质量比是 [ ]
![]()
7.对于木炭,一氧化碳和氢气分别跟氧化铜的反应(在适当条件下)下列叙述正确的是 [ ]
A.都是还原剂 B.都是置换反应
C.都有二氧化碳生成 D.都有红色物质生成
8.t℃时,某物质的溶解度为10克,在其饱和溶液中溶液、溶剂、溶质之间的质量比正确的是 [ ]
A.溶液:溶质=11:1 B.溶液:溶剂=10:11
C.溶剂:溶质=11:10 D.溶质:溶剂=1:10
9.下列各组物质加水充分搅拌,各物质间恰好完全反应,过滤,在滤纸上能留下两种不溶物的是
[ ]

![]()
价可能是下列关系中的 [ ]
![]()
三、填空题
1.稀有气体在通电时会发出有色光,灯管中充入_______,通电时会发出蓝紫色光;灯管中充入氖气时会发出_________色光.
2.无水硫酸铜是___________色固体,如滴入少量药用酒精后变色,说明药用酒精中含__________,其化学方程式是__________.
3.在化学反应前后原子的________没有_________,原子的_________没有_______,因此质量守恒.在反应AB+CD=AD+BC中若12克AB和40克CD恰好完全反应,生成22克AD,则10克AB最多能反应生成__________克BC.
4.硝酸钾中混有少量食盐可用__________方法除去;硝酸钠中混有少量硫酸铁可用______(填试剂名称)除去,其化学方程式_______.
5.浓度为20%的某盐溶液300克降温到20℃时有10克无水晶体析出,该物质在20℃时的溶解度是__________.
6.在氢氧化钙中有一部分已变质,共17.4克,滴加浓度为18.25%的盐酸溶液,完全反应后放出气体为4.4克,则变质的氢氧化钙占总氢氧化钙的百分含量是_________.
7.有A、B、C三种元素,A元素的离子带1个单位正电荷,核外没有电子;B元素的核外有三个电子层,M层(第三层)比K层(第一层)多5个电子;C元素的原子其M层(第三层)上只有1个电子.A、B、C三种元素的名称是______、_______和______.
8.实验室配制50克5%的NaCl溶液,应称取________克NaCl倒入干燥、洁净的烧杯里,然后用__________量取_________毫升水,倒入盛有NaCl的烧怀里,并不断用__________搅拌,使NaCl完全溶解,即得所需溶液.
![]()
电子;B、C、D都只有一个原子核,且都具有稳定的电子层结构;B原![]()
是电中性的,且比B少一个电子层.
(1)写出下列微粒的名称:B__________,C__________,D__________.
![]()
该盐的电离方程式为_______.
四、实验题
下图是某学生设计的制取氢气, 并用氢气还原氧化铜的实验装置图.

回答下列问题
(1)改正装置中的错误之处:①_________.②________.③_________.
(2)试管A中药品的名称是_________________.
(3)试管B中反应的化学方程式_________________.
(4)该实验步骤有:
a.在试管中装入药品
b.往试管B通氢气
c.停止向试管B通氢气
d.停止加热试管B
e.加热试管B
f.检查氢气发生装置的气密性
g.检验氢气的纯度
下列表示正确操作顺序的一组是:
①faegbcd ②afgbedc ③faebdcg
④afgebcd ⑤fagbedc
(5)试管B中的实验现象是_______________.
五、计算题
1.用氢气还原16克氧化铜,反应一段时间后,生成6.4克铜,剩余的干燥氧化铜与100克稀硫酸恰好完全反应,求
(1)有多少克氧化铜被氢气还原?
(2)将得到的硫酸铜溶液蒸发掉多少克水后,在18℃时刚好达到饱和?
(18℃时硫酸铜溶解度为20克.)
2.(1)中和100克浓度为36.5%的盐酸需浓度为40%、密度为![]()
(2)若将中和后的溶液冷却至20℃有多少克晶体析出?
(3)析晶后剩余溶液的百分比浓度是多少?(20℃时食盐的溶解度为36克)