化学实验专项训练二
【例题精选】
例1.现有K2SO4溶液、Na2CO3溶液、AgNO3溶液,请用一种药品将它们一一区分出来。
分析:
这是一个试管实验,仪器及操作并不困难关键在于确定一种药品。
思路:
被检验的物质均为盐的溶液,因此应在酸、碱、盐的范围内“找”这种药品。
该药品或可以和上述三种不同的盐溶液都发生反应——但实验现象完全不同,从而将这三种不同的盐溶液区分开;
该药品或可以和上述三种盐溶液之中的两种溶液发生反应——实验现象不同,而与第三种盐溶液不发生反应,从而将这三种不同的盐区别开。因此这种试剂必须能提供阴、阳两种离子,阴离子必须满足只跟Ag+、Na+、K+中的一种离反应,当然应该想到是Cl-即Ag+与Cl-结合,生成AgCl沉淀。
阳离子必须能与NO3-、CO32—、SO42—中的两种离子——CO32—或SO42—发生反应,但Ba2+不行。因为BaSO4、BaCO3均为白色沉淀。而H+ 则可以——H+不与SO42—发生反应,而与CO32—则发生反应而生成气泡,从而选定这种试剂为盐酸。
AgNO3 + Hcl ![]() AgCl
AgCl![]() + HNO3
+ HNO3
Na2CO3
+ 2Hcl ![]() 2NaCl + H2o
+ CO2
2NaCl + H2o
+ CO2![]()
K2SO4与盐酸不发生反应。
从而用一种试剂将上述三种盐溶液区别开来了。
例2.有甲、乙、丙三种实验装置如图:
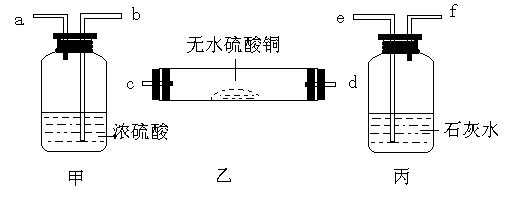
有一不纯的一氧化碳气体,其中混有少量的二氧化碳和水蒸气。现提供上述甲、乙、丙三种实验装置,如果用来⑴证明混有这两种气体;⑵除去这两种气体气体。回答:
①甲装置的作用是 。
乙装置的作用是 。
丙装置的作用是 。
③为了达到上述 ⑴和⑵的目的,请用甲、乙、丙三种装的接口代号,表示出正确的接连顺序:
不纯的一氧化碳![]()
![]() 纯净的一氧化碳。
纯净的一氧化碳。
首先考虑上述三种装置的功能及作用:
| 装置 | 反应 | 功能 | 说明 |
| 甲 | H2SO4+ H2O H2SO4·H2O (此化学方程式不作 要求) | 除尽水 | 因为水蒸气的量很小,被浓H2SO4吸收后,液体体积变化微小,故不能用于证明水蒸气 |
| 乙 | CuSO4+5H2O CuSO4·5H2O | 证明水 | 因为气体是在其上方通过,故不能用来除尽水 |
| 丙 | Ca(OH)2+CO2 CaCO3 | 证明二氧化碳 除去二氧化碳 | 用一瓶石灰水可以证明及除去少量的CO2 |
确定甲、乙、丙三套装置的功能及作用以后,再考虑三种仪器装置的连接顺序——由于各种物质的水溶液经洗气后,都会带有少量的水蒸气,因此必须先用乙装置证明混合气体之中含有(或说混有)水蒸气,所以乙装置必须排在前边。为了确保最终得到的是干燥的纯净的气体,则必须把甲装置放在最后边。因而丙装置就只能放在中间了。
最后考虑得出甲、乙、丙三种装置间接口的边结应为:
不纯的一氧化碳 → c、d(或d 、c)→ e、f → b、a → 纯净的一氧化碳。
【专项训练】
A组习题
(一)选择题(每小题只有一个答案符合题意,请将正确的选项的题号写在题后的括号里)
1.下列各组气体中,可用同一种方法收集,且该方法是组内每种气体的最好收集方法这样的一组是( )
A.H2、O2、CO2 B.H2、O2、CO2
C.H2、CO2、、O2 D.O2、CO、CO2
2.下列实验操作中正确的是( )
A.将剩余的药品放回原瓶子中。
B.把被加热的物质放在酒精灯的内焰部分加热
C.给燃着的酒精灯添加酒精
D.氢气还原氧化铜,氧化铜变色后,停止加热,继续通氢气直至试管冷却到室温
3.下列各组气体中,能用相同的制气和收集装置的是( )
A.CO2、O2 B.H2、CO2 C.H2、O2 D.都不能
4.实验室制取氧气,操作步骤为①点燃酒精灯给试管加热;②熄灭酒精灯;③检查仪器装置的气密性;④把氯酸钾及二氧化锰装入试管后固定在铁架台上;⑤用排水法收集;⑥将导管移出水面等六步,正确操作的顺序是( )
A.③④①⑤②⑥ B.③④①⑤⑥②
C.④③①⑤⑥② D.④③①⑤②⑥
5.鉴别碳酸盐常用的药品是( )
A.稀盐酸 B.澄清石灰水
C.稀盐酸和澄清石灰水 D.稀硫酸
6.除去CO2中混有的CO(少量),应采用的正确方法是( )
A.将气体通入浓硫酸中
B.将气体通入石灰水中
C.将气体通过赤热的氧化铜
D.将气体通过赤热的碳
7.将空气依次通过烧碱溶液、浓硫酸和灼热的铜丝,最后剩下的气体是( )
A.氮气及稀有气体 B.氮气、二氧化碳及稀有气体
C.氮气、氧气与稀有气体 D.水蒸气与稀有气体
8.下列各组物质中,加入适量的盐酸后过滤,不能将混有的杂质除净的是( )
A.铜粉中混有少量的铁粉 B.NaCl中混有少量的CaCO3
C.Na2SO4中混有少量的CaCO3 D.木炭粉中混有少量的镁粉
9.下列各组物质的水溶液,能分别使紫色石蕊试液依次显示红、紫、蓝三种颜色的是( )
A.Na2SO4、NaOH、NaCl
B.CO2、BaCl2、CaO
C.Hcl、NaOH、NaCl
D.KOH、HNO3、NaCl
*10.有一蓝色溶液,加入铁屑后出现红色固体;若有蓝色溶液中加入氯化钡溶液则出现白色沉淀,再滴入稀硝酸,白色沉淀不消失。根据以上分析,判断该蓝色溶液是( )
A.CuCO3 B.CuSO4 C.Cu(NO3)2 D.FeSO4
(二)填空
1.有一白色粉末A,到少量进行以下的实验:
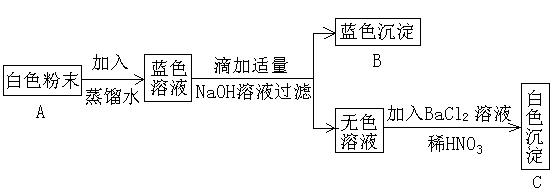 试推判:(写化学式)
试推判:(写化学式)
蓝色沉淀B是 ,发生反应的化学方程式是
,白色沉淀C是 ,发生反应的化学方程式是
,由此推断白色粉末A是 。
2.填写实验报告:
| 实验内容 | 观察到的现象 | 反应的化学方程式 |
| 在盛有CuSO4溶液试管中加入锌粒⑴ | ||
| 给试管里的胆矾粉末加热⑵ | ||
| 在盛有FeCl3溶液的试管中滴加烧碱溶液⑶ |
3.有甲、乙、丙三种物质,已知甲为钠盐,乙为氯化物,丙为碱。经过实验有如下现象:
⑴甲、乙两种物质的溶液混合后没有气体或沉淀生成;
⑵乙、丙两种物质的溶液混合后有蓝色的沉淀出现;
⑶甲、乙两种物质的溶液混合后有白色沉淀出现,该沉淀不溶于稀硝酸。
推断:(写化学式)
甲是 ,乙是 ,丙是 。
4.有一固体粉末,可能由CaCO3、KNO3、CuSO4、Na2SO4、BaCl2 中的一种或几种所组成,通过实验得到以下结果:
⑴该固体粉末加到水中,得到白色沉淀,上层为清液且无色;
⑵滴加稀硝酸后,白色沉淀不溶解。
从以上的实验可以推出:
该物体粉末中一定含有 ,可能含有 ,一定不含有 。
5.把铜片、锌片同时放入盛有硝酸银溶液的试管中,反应完全停止后,锌片有剩余,因此溶液中大量存在的离子是 ,经过滤后得到的固体有 。
6.胆矾中结晶水的质量分数为
7.在20℃时,食盐的溶解度为36克。将20克食盐放入50克水中,得到饱和溶液的质量是 克,该饱和溶液的溶质的质量分数是 。
8.有下列物质: ⑴烧碱;⑵盐酸;⑶消石灰;⑷大理石;⑸碳酸钠;⑹硫酸;⑺二氧化碳。请按要求从中选出适当的物质,将所选物质的化学式填在相应的空格上:
少量存在于人的胃液中以帮助消化的是 ;能用于砌墙,抹墙及降低酸性土壤酸性的是 ;能够提高温室中农作物产量的是 ;具有强烈腐蚀性并且固体可用作干燥剂的是 ;作为矿物存在于自然界之中,并且可以用作建筑材料的是 。
(三)化学计算
1.含有碳酸钙杂质的氯化钙样品80克,恰好与124.4克质量分数为5.87的盐酸完全反应。
求:⑴该样品中含杂质碳酸钙的质量分数。
⑵反应后所得溶液的质量分数。
⑶如果在此温度下,所得到的溶液为饱和溶液,那么此饱和溶液的溶解度是多
少?
2.工业上用还原的方法以含铁矿石中冶炼生铁。现要以三氧化二铁的质量分数为80%的赤铁矿石中,冶炼出100吨铁的质量分数为98%的生铁,那么需要这种赤铁矿石多少呢?
3.现有一氧化碳与二氧化碳的混合气体,通入灼热的氧化铜粉末,待充分反应后,消耗了氧化铜0.8克。如果将该混合气体通入过量的澄清的石灰水中,充分反应,生成了沉淀2.0克。求:原混合气体中,一氧化碳与二氧化碳的质量各是多少克?
4.把5.0克含有少量杂质的食盐样品(所含杂质不容于水),放入44.1克水中充分搅拌,使样品中的氯化钠完全溶解。将得到的悬浊液进行过滤,然后取出5.85克滤液,并在其中滴入硝酸银溶液直到沉淀不再产生时为止。把得到的沉淀充分干燥后进行称量,沉淀质量为1.435克。求:
⑴第一次过滤后所得滤液中溶质的质量分数是多少?
⑵不纯的食盐样品中氯化钠(NaCl)的质量分析是多少?
5.在t℃时,149克溶质的质量分数为30%的氯化钾溶液,与此108.8毫升(密度为1.25![]() )的硝酸银溶液恰好完全反应。求:
)的硝酸银溶液恰好完全反应。求:
⑴反应后溶液中溶质的质量分数是多少?
⑵将上述反应后的溶液过滤后,得到的滤液恰好为饱和溶液,那么在t℃时,硝酸钾的溶解度是多少?
6.现有73克10%的盐酸溶液,恰好与80克某浓度的氢氧化钠溶液完全反应,将反应后的溶液蒸发掉108.8克水后,再冷却到20℃,溶液恰好达到饱和。求:
⑴氢氧化钠溶液中溶质的质量分数?
⑵20℃时,此反应生成物的溶解度?
B组习题
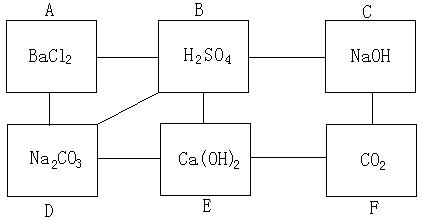
1.现在NaCl2、Na2CO3 、Ca(OH)2 、 稀H2SO4 、NaOH五种溶液及CO2。请按下图所表示的关系,将这六种物质填入相应的长方格中(长方格之间的连线,表示长方格内的物质能够发生反应),并写出有关么应的化学方程式。
图如下:
2.在20℃时,将6.99克氯化钠与硫酸钠的混合物溶于22克水中,然后再加入31.2克质量分数为20%的氯化钡溶液,恰好沉淀不再产生。
求:⑴反应后的溶液中溶质的质量分数。
⑵若要使反应的溶液成为20℃时的饱和溶液,需加入氯化钠的质量是多少?
【答案】:
A组
(一)选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | D | D | B | C | C | A | C | B | B |
(二)填空题:
1.B.Cu(OH)2 CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
C.BaSO4 NaSO4+BaCl2→BaSO4+2NaCl
A.CuSO4 (无水)
2.
⑴锌粉上覆盖有红色物质,溶液的蓝色消失。Zn+CuSO4→ZnSO4+Cu
⑵蓝色粉末逐渐变成白色,试管口部有无铯液滴汇集。CuSO4·5H2O![]() CuSO4+5H2O⑶有红褐色的沉淀生成。FeCl3+3NaOH→Fe(OH)3↓+3NaCl
CuSO4+5H2O⑶有红褐色的沉淀生成。FeCl3+3NaOH→Fe(OH)3↓+3NaCl
3.甲 Na2CO3 乙 CuCl2 丙 Ba(OH)2
4.BaCl2 Na2SO4 CaCO3 KNO3 CuSO4
5.Zn2+ NO3— , Zn Cu Ag
6.36%
7.68克 26.5%
8.Hcl (盐酸) Ca(OH)2 CO2 NaOH CaCO3
(三)化学计算
1.解:设反应需要的CaCO3的质量为x,生成CaCl2 H2O CO2的质量分别为y, z, x1
CaCO3 + 2Hcl → CaCl2 + H2O + CO2↑
100 73 111 18 44
x 124.4克×5.87% y z x1
=7.3克
分析解出:
x=10.0克 y=11.1克
z=1.8克 x1=4.4克
⑴碳酸钙的质量分数
![]()
⑵氯化钙的质量分数
![]()
⑶水的质量:![]()
溶质CaCl2的质量:![]()
∴所求溶解度S为
S![]()
答:略
2.解:设需要赤铁矿石的质量为x
Fe2O3 + 3H2 ![]() 2Fe +
3H2O
2Fe +
3H2O
160 112
x×80 100吨 ×98%
![]()
![]()
答:略
3.解:设混合气体中一氧化碳的质量为x,二氧化碳的质量为y,反应生成的二氧化碳的质量为z 。
CO + CuO ![]() Cu + CO2
Cu + CO2
28 80 44
x 0.8克 z
![]()
![]()
x![]() 、、、 z
、、、 z![]()
![]()
![]()
Ca(OH)2 + CO2 → CaCO3↓ + H2O
44 100
(y+z) 2.0克
![]()
![]()
![]()
![]()
答:略
4.解:设5.85克滤液中含NaCl的质量为x,样品中含NaCl的质量为y。
⑴NaCl + AgNO3 → AgCl↓ + NaNO3
58.5 143.5
x 1.435克
![]()
![]()
∴溶液中溶质的质量分数为:![]()
⑵![]()
解得:![]()
∴样品中NaCl的质量分数为:![]()
答:略
5.解:设反应后生成的AgCl的质量为x ,生成KNO3的质量为y,KNO3的溶解度为S。
Kcl + AgNO3 AgCl↓ + KNO3
74.5 143.5 101
149克×30%=44.7克 x y
![]()
![]()
![]()
![]()
溶液的质量:
![]()
∴溶液中溶质的质量为分数为:![]()
溶剂的质量为:![]()
∴KNO3的溶解度S为:![]() ∶
∶![]() ∶S
∶S
S![]()
答:略
6.解:设参加反应的NaOH的质量为x,反应生成的NaCl的质量为y。
NaOH + Hcl → NaCl + H2O
40 36.5 58.5
x 73克×10% y
![]()
![]()
![]()
![]()
⑴NaOH溶液中溶质的质量分数为:![]()
⑵溶液的质量:![]()
溶剂的质量:![]()
∴20℃时NaCl的溶解度S为:![]() ∶
∶![]() ∶S
∶S
S![]()
答:略
B组题
1.分析:⑴所给的六种物质中,有两种碱,两种盐,一种酸及一种酸性氧化物。
⑵要知道酸、碱、盐之间能发生复分解反应,但要考虑发生反应的条件。
⑶酸性氧化物能与碱反应生成盐和水。由此应该想到酸性氧化物——CO2只能
填在图中F这个长方格中。而C格及E格可以考虑填所给定的两种碱。
⑷对BaCl2要想到在给定的六种物质中,它只能与稀 H2SO4及Na2CO3反应,应
填A格中。
⑸对Na2SO4,在给定的六种物质中,它可以和BaCl2、H2SO4、Ca(OH)2这三
种物质发生反应,因此它应填在D格内。
、、⑹对稀H2SO4,它在给定的六种物质中,可以和NaOH、Ca(OH)2、BaCl2、
Na2CO3这四种物质发生反应,因此应填入B格内。
⑺对Ca(OH)2,它在给定的六种物质中,能与稀H2SO4、Na2CO3这两种物质反
应,因此应填入E格内。
⑻对NaOH,它在给定的六种物质中能与稀H2SO4与CO2反应,恰好填在C格
内。如下:
|
|
解:
有关反应的化学方程式;
A与B:BaCl2 + H2SO4 → BaSO4↓+2Hcl
B与C: H2SO4 + 2NaOH → Na2SO4 + 2H2O
A与D:BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
B与D:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑
C与F:2NaOH + CO2 → Na2CO3 +H2O
D与E:Na2CO3 + Ca(OH)2→ CaCO3↓+2NaOH
E与F: Ca(OH)2 + CO2 → CaCO3↓+H2O
B与E:H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
2.分析:通过细心审题,不难看出——原混合物中含有NaCl,而发生化学反应后,生成物中也有NaCl,能分析到这一点,则此题就不难求解了。
解:设有混合物中含有Na2SO4的质量为x,生成BaSO4沉淀的质量为y,生成NaCl的质量为z。
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
208 142 233 117
31.2克×20% x y z
可以分别求出:
NaCl的总质量为:![]()
⑴反应后溶液中溶质的质量分数为:
![]()
⑵没应加入NaCl的质量为x1
![]()
解得:![]()
答:略