第四章 化学方程式专项训练
【例题精选】:
例1 下列各式中,正确表示实验室制氧气的反应的化学方程式是
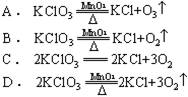
解析:书写正确的化学方程式,首先:要遵循客观事实,要写出正确的化学式。氯酸钾受热生成气体是氧气,氧气的一个分子中有两个氧原子,其化学式为O2。A式中写成O3,这是另一种气体(臭氧)的化学式。其次:要遵循质量守恒定律,方程式要配平,即使等号两边原子的种类、原子的个数一样。B式中表示的氧原子个数反应前后不一样多。第三:完整的方程式要把反应条件在等号上下标出来,把生成物是气体还是沉淀用箭头号标出来。C式中没有写二氧化锰做催化剂、点燃做条件,没有标出反应的产物氧气常温下是气体。
答案:D
例2 对于化学方程式![]() 的意义叙述正确的是
的意义叙述正确的是
A.氢气加氧气点燃等于水
B.两个氢气和一个氧气点燃生成两个水
C.每4份质量的氢气和32份质量的氧气点燃生成36份质量的水
D.4克氢气和32克氧气点燃生成36克水
解析:任何一个化学符号(包括元素符号、化学式及化学方程式)都具有宏观、微观、质量三方面的含义。对于一个化学方程式,宏观上表示反应物与生成物的种类,即氢气和氧气点燃后生成水,要注意宏观物质只有种类可分,无个数而言,不可读为两个氢气和一个氧气点燃生成两个水。方程式还可表示反应条件,此方程式表示氢气和氧气常温下是不发生这个反应的,必须以点燃为条件。从质量上看,氢气的式量为2,氧气的式量为32,水的式量为18,利用化学式的个数,找出反应物与生成物的质量关系为:氢气∶氧气∶水=4∶32∶16由于化学式的式量是相对质量,单位是1,故叙述时只说几份质量即可,一般不用具体单位克、千克表示。A式中的描述是用数学方法读化学符号。
答案:C
例3 下列描述符合质量守恒定律的是
A.6克碳在5克氧气中充分燃烧可生成11克二氧化碳
B.6克碳与20克氧气充分反应可生成22克二氧化碳
C.3克碳与8克氧气反应生成11克二氧化碳
D.8克碳与16克氧气充分反应生成24克二氧化碳
解析:判断化学反应中的质量关系,应根据方程式计算:
(1)写出正确的方程式 C
+ O2 ![]() CO2
CO2
(2)计算各化学式的质量总和 12 32 44
(3)约简找出最简整数比 3 8 11
当反应物与生成物呈现 C∶O2∶CO2=3∶8∶11时,符合质量守恒定律。有些描述表面上看,给的质量不符合质量关系,那就要看是否有物质过量。如B描述中6克碳充分反应中需16克氧气,题目给20克氧气,将有4克剩余,生成22克二氧化碳仍符合质量守恒定律。
答案:B、C
例4 某物质在空气中燃烧,生成物中只有水和二氧化碳,则该物质的组成是
A.一定有氧元素
B.一定有碳元素
C.一定有碳、氢元素,可能有氧元素
D.一定有碳、氢元素,没有氧元素
解析:某物质可用符号A来表示,依题意可写A+O2 ![]() H2O+CO2,根据质量守恒定律的微观解释,化学反应前后元素的种类不变,生成物中共存在有碳、氢、氧三种元素,因此反应物中也一定有这三种元素,其中氧元素可能由氧气提供,也可能部分由氧气提供,则该物质中必然有碳、氢元素,氧元素可能存在。
H2O+CO2,根据质量守恒定律的微观解释,化学反应前后元素的种类不变,生成物中共存在有碳、氢、氧三种元素,因此反应物中也一定有这三种元素,其中氧元素可能由氧气提供,也可能部分由氧气提供,则该物质中必然有碳、氢元素,氧元素可能存在。
答案:C
例5 将2.3克某物质在氧气中燃烧,可得到4.4克二氧化碳和2.7克水,则该物质中
A.一定有碳、氢、氧三种元素
B.一定有碳、氢元素,可能有氧元素
C.一定有碳、氢元素,没有氧元素
D.无法判断
解析:这是一道利用计算确定物质组成的题,该物质可用A表示,该反应可写成A +O2![]() H2O + CO2。利用反应前后元素种类不变的事实,可确定A中一定含有碳、氢元素,关键是有无氧元素。根据质量守恒定律,参加反应的氧气质量=4.4克+2.7克-2.3克=4.8克,再根据化学式的计算判断生成物中一共存在多少克氧元素,若与氧气的质量相等,说明A物质中没有氧元素,若大于氧气质量,说明有部分氧元素由此物质提供,计算如下:
H2O + CO2。利用反应前后元素种类不变的事实,可确定A中一定含有碳、氢元素,关键是有无氧元素。根据质量守恒定律,参加反应的氧气质量=4.4克+2.7克-2.3克=4.8克,再根据化学式的计算判断生成物中一共存在多少克氧元素,若与氧气的质量相等,说明A物质中没有氧元素,若大于氧气质量,说明有部分氧元素由此物质提供,计算如下:
设生成4.4克二氧化碳中含有氧元素质量为x
CO2——2O
44 32
4.4克 x
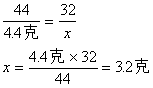
设生成2.7克水中氧元素质量为y
H2O——O
18 16
2.7克 y
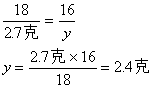
生成物中氧元素总质量=3.2克+2.4克=5.6克
∵5.6>4.8
答案:A
例6 将A、B、C三种物质各10克混和后放入试管中加热,发生如下反应:A+2B ![]() C+2D。至反应不再发生时,测得剩余物中有3克A,22克C,其中B无剩余,则生成物D的质量为
C+2D。至反应不再发生时,测得剩余物中有3克A,22克C,其中B无剩余,则生成物D的质量为
A.2.5克 B.5克 C.6克 D.12克
解析:该题是利用质量守恒定律,计算宏观物质质量的习题,要明确与反应式中各物质的系数无关。起始时A、B、C各10克。并非都是反应的。反应后A剩余3克,说明参加反应的有7克;B无剩余,说明参加反应的B为10克;C为22克,说明生成了12克C,由于参加反应的各物质质量总和一定与生成的各物质质量总和相等。故D的质量=7+10-12=5(克)
答案:B
例7 在反应4A+3B![]() 2D中,已知A的式量为27,D的式量为102,则B的式量为
2D中,已知A的式量为27,D的式量为102,则B的式量为
A.75 B.24 C.32 D.8
解析:这是一道利用化学方程式,从微观角度计算式量的题,明确计算过程与系数有关。
4A +
3B![]() 2D
2D
4×27 3x 2×102
=108 =204
3x=204-108=96
x=32
答案:C
例8 判断化学方程式4x + 5B2 === 4AB2 + 2C2B中,x的化学式为
A.A2C2 B.AC C.A2B D.CA
解析:此题从微观角度判断物质的化学式要注意化学式的个数。根据质量守恒定律,反应前后原子的种类不变,原子的个数也没有增减,此方程式生成物中A原子个数为4,B原子个数为10,C原子个数为4,反应物中5B2恰好提供10个B原子,故4个A原子,4个C原子均由2个x分子提供,一个x分子由两个A原子两个C原子构成。
答案:A
例9 将m个A2分子与n个AB2分子放入集气瓶内密闭加热,使之充分反应后,集气瓶内A与B原子的个数比为
A.无法判断 B.![]() C.
C.![]() D.
D.![]()
解析:此题不是判断生成物化学式,因此与反应中谁过量无关,由于在密闭容器,反应物的原子个数就是生成物原子的个数,因此m个A2分子共2m个A原子,n个AB2分子共n个A原子2n个B原子,故原子个数比A∶B=(2m+n)∶2n
答案:B
例10 已知氢气与氧气反应的方程式为2H2+O2 ![]() 2H2O,现将10克氧气与氢气的混合气体点燃,一共生成9克水,那么原混合气体中氢气与氧气的质量比为
2H2O,现将10克氧气与氢气的混合气体点燃,一共生成9克水,那么原混合气体中氢气与氧气的质量比为
A.1∶9 B.1∶4 C.1∶5 D.2∶1
解析:原混合气体共10克,若恰好完全反应,则应生成10克水,现生成9克水,说明有1克气体过量,此气体可能是氢气,也可能是氧气。根据生成9克水的客观事实,可求出原气体中氢气与氧气的最小质量:
设生成9克水最少需氢气和氧气的质量分别为x、y
2H2 +
O2 ![]() 2H2O
2H2O
4 32 36
x y 9克
![]()

判断:若最少提供1克氢气,氧气为9克,若最少需8克氧气,氢气为2克。
答案:A、B。
【专项训练】:
一、选择:
1、书写化学方程式必须遵守质量守恒定律,其本质原因是
A.参加反应的各物质的质量总和等于反应后生成的各物质的质量总和
B.在化学反应前后原子的种类没有改变
C.在化学反应前后原子的质量没有变化
D.在化学反应前后,原子的种类没有改变,原子的数目没有增减,原子的质量也没 有变化
2、任意取一些红磷,使之在一盛有氧气的密闭玻璃瓶中燃烧,其结果必然是
A.氧气耗尽,使反应停止,红磷有余
B.红磷完全燃烧,毫无剩余
C.发出强烈的白光,瓶内充满白色气体
D.生成物是白色固体,红磷是否完全燃烧不能判断
3、用白磷在锥形瓶中燃烧做质量守恒定律的实验时,若锥形瓶口的胶塞没有塞紧,会使实验的结果可能为
A.锥形瓶等整体的质量变轻
B.锥形瓶等整体的质量变重
C.锥形瓶等整体的质量不变
D.白磷不能够很好地燃烧
4、在化学反应前后,下列诸项中肯定没有变化的是
原子数目 ‚分子数目 ƒ元素种类
„物质种类 …物质状态 †原子种类
A.‚ƒ B.„…† C.‚„… D.ƒ†
5、在化学反应![]() 中,反应物中各物质间的质量比为
中,反应物中各物质间的质量比为
A.1∶1 B.3∶1∶2∶3
C.3∶80∶56∶27 D.1∶80∶28∶9
6、在下列反应2AB+B2 == C中,C的化学式为
A.AB2 B.A2B C.A2B4 D.A4B2
7、在化学反应A+B==C+2D中,若5克A和3克B恰好完全反应,生成2克C和若干克D,则生成C与D的质量比为
A.1∶3 B.3∶1 C.2∶3 D.3∶2
8、有下列反应:A+2B==C+D,5.6克A与7.3克B恰好完全反应生成12.7克C,现要得到0.4克D,则所需A的质量为
A.5.6克 B.11.2克 C.14.6克 D.无法计算
9、在![]() 的反应中,下列有关叙述正确的是
的反应中,下列有关叙述正确的是
硫的质量小于二氧化硫的质量
‚硫的质量等于二氧化硫的质量
ƒ硫的质量等于氧气的质量
„氧气和硫的质量都等于二氧化硫的质量
A.只有 B.‚„ C.ƒ D.只有„
10、质量相同的碳、硫、磷分别在氧气中充分燃烧,消耗氧气的质量最多的是
A.碳 B.硫 C.磷 D.一样多
11、3克红磷在3克氧气中燃烧,生成的五氧化二磷质量
A.6克 B.大于6克 C.小于6克 D.无法判断
12、氢气与氧气的混合气体共20克,在密闭的容器内点燃充分反应,将生成的水除去后,剩余2克气体,则该气体是
A.一定是氢气 B.一定是氧气
C.一定是氢气与氧气的混合气体 D.可能是纯氢气,或者是纯氧气
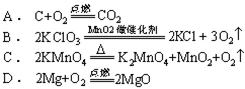
13、下列化学方程式错误的是
14、下列物质间的反应,属于置换反应的是
A.H2 + CuO ![]() Cu+H2O
Cu+H2O
B.CH4 + 2O2 ![]() CO2 +
2H2O
CO2 +
2H2O
C.2NaOH + CuSO4 === Cu(OH)2¯+ Na2SO4
D.2H2O ![]() 2H2 + O2
2H2 + O2
15、某学生在做氢气还原氧化铜实验时,若将8克氧化铜完全还原成铜,实际上消耗氢气的质量是
A.0.2克 B.大于0.2克 C.小于0.2克 D.0.1克
16、将x克某二价金属M放入足量盐酸中,充分反应后得到a克氢气,则M的原子量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
17、相同质量的钠、镁、铝分别跟足量盐酸反应,生成氢气的质量比是
A.1∶2∶3 B.3∶2∶1 C.![]() ∶
∶![]() ∶
∶![]() D.23∶12∶9
D.23∶12∶9
18、一定质量的钠、镁、铝分别放入足量稀硫酸中,当生成氢气的质量相等时,参加反应的钠、镁、铝的原子个数比是
A.1∶1∶1 B.1∶2∶3 C.3∶2∶1 D.6∶3∶2
二、下列说法是否正确,正确的画“ü”,错误的画“×”。
1、反应物的总质量一定等于生成物的质量总和。
2、方程式中不注明条件,就表明此反应在通常情况下即可反应。
3、方程式中只要是气体就需用向上箭头表示。
4、化学反应前后,分子的总数不变。
5、化学反应前后,元素的种类不变。
6、化学反应的实质就是参加反应的各物质的原子,重新组成其它物质的过程。
7、化学方程式NH4HCO3 ![]() NH3+H2O+CO2和NH3+H2O+CO2==NH4HCO3表示的是同一反应。
NH3+H2O+CO2和NH3+H2O+CO2==NH4HCO3表示的是同一反应。
8、化学方程式2H2 + O2 ![]() 2H2O可以表明水是由氢气和氧气组成的。
2H2O可以表明水是由氢气和氧气组成的。
9、方程式C+O2 ![]() CO2可以读作碳和氧气点燃时生成二氧化碳。
CO2可以读作碳和氧气点燃时生成二氧化碳。
10、等质量的A、B、C三种物质混合后放入试管加热,待反应停止后A的质量减少,C的质量增加,B消失,同时产生新物质D,该反应可表示为:A+B+C ![]() C+D
C+D
三、填空:
1、在化学反应:2A+B==C+2D中,若A的式量为15,B的式量为20,C的式量为12,D的式量应当为 ;
2、在反应2KClO3 ![]() 2KCl +3O2的各物质中,属于单质的有 ,属于氧化物的有 ,属于化合物的有 。(填写化学式)
2KCl +3O2的各物质中,属于单质的有 ,属于氧化物的有 ,属于化合物的有 。(填写化学式)
3、把氢气和氧气的混合气体10克,装在密闭容器中用电火花点燃,充分反应后生成4.5克水蒸气,则反应前混合气体中含氧气可能为 克或 克。
4、将氯酸钾和MnO2的混合物共50克放入试管内加热,至不再有气体产生时试管内剩余固体质量为30.8克,则反应生成氧气 克,剩余固体中有氯化钾 克,二氧化锰 克,参加反应的氯酸钾 克。
5、在化学反应2Mg + O2 ![]() 2MgO中,反应物与生成物的质量比:Mg∶O2∶MgO=
2MgO中,反应物与生成物的质量比:Mg∶O2∶MgO=
。
四、配平方程式
1、下列方程式哪个是错误的,在后面的横线上写出正确的。
(1)C+O2===CO2
(2)2S+O2 ![]() 2SO
2SO
(3)P+O2 ![]() P2O5
P2O5
(4)Fe+O2 ![]() Fe2O3
Fe2O3
(5)K2MnO4 ![]() KMnO4
+ MnO2 + O2
KMnO4
+ MnO2 + O2
(6)2Mg+O2 ![]() 2MgO
2MgO
2、给下列方程式配平
(1)Cu2(OH)2CO3 ![]() CuO+H2O+CO2
CuO+H2O+CO2
(2)Fe+O2 ![]() Fe3O4
Fe3O4
(3)WO3+H2 ![]() W+H2O
W+H2O
(4)CH4+O2 ![]() H2O+CO2
H2O+CO2
3、写出下列反应的方程式
(1)氢气与三氧化二铁在加热时生成铁和水
(2)二氧化碳通入澄清石灰水[Ca(OH)2]生成碳酸钙(CaCO3)和水
(3)酒精(C2H5OH)燃烧生成水和二氧化碳
(4)硫酸铜(CuSO4)和氢氧化钠(NaOH)反应生成硫酸钠(Na2SO4)和氢氧
化铜[Cu(OH)2]沉淀
五、计算题:
1、3.1克磷在足量氧气中反应可生成五氧化二磷多少克?
2、将12.25克氯酸钾与1克二氧化锰混合后加热至反应完成后
(1)生成氧气多少克?
(2)生成物中氯化钾为多少克?
(3)反应后剩余固体总质量多少克?
3、8克硫充分燃烧生成二氧化硫需氧气多少克?若在空气中燃烧,需空气多少升?(氧气密度为1.43克/升)
【答案】:
一、
1、D 2、D 3、B 4、D 5、C 6、C
7、A 8、B 9、C 10、A 11、C 12、D
13、B 14、A 15、B 16、B 17、C 18、D
二、
1、× 2、ü 3、× 4、× 5、ü 6、ü
7、× 8、× 9、ü 10、×
三、
1、19 2、O2,‚MnO2,ƒKClO3,MnO2和KCl
3、9.5克或4克
4、19.2克;‚29.8克;ƒ1克;„49克。
5、3∶2∶5
四、
1、(1)C+O2 ![]() CO2
CO2
(2)S+O2
![]() SO2
SO2
(3)4P+5O2
![]() 2P2O5
2P2O5
(4)3Fe+2O2
![]() Fe3O4
Fe3O4
(5)2KMnO4
![]() K2MnO4+MnO2+O2
K2MnO4+MnO2+O2
(6)对
2、(1)1,2,1,1
(2)3,2,1
(3)1,3,1,3
(4)1,2,2,1
3、(1)3H2+Fe2O3![]() 2Fe+3H2O
2Fe+3H2O
(2)CO2+Ca(OH)2 === CaCO3¯+H2O
(3)C2H5OH+3O2
![]() 2CO2+3H2O
2CO2+3H2O
(4)CuSO4 + 2NaOH === Cu(OH)2¯+Na2SO4
五、
1、7.1克
2、(1)4.8克;(2)7.45克;(3)8.45克
3、(1)8克;(2)26.6升