中考模拟卷
一. 选择题(每小题1分,共16分。每小题只有一个选项,符合题意。)
1. 厨房里发生的下列变化,属于物理变化的是( )
A. 食物腐败 B. 天然气燃烧 C. 水的沸腾 D. 菜刀生锈
2. 某省境内有一座著名的龙泉寺,寺内有一泉眼,泉水常年流淌不断,经测定泉水中含有人体所需的多种矿物,其物质组成中所含的锌、钙、硒等指的是()
A. 原子 B. 分子 C. 元素 D. 单质
3. 下列基本类型的反应中,一定有单质生成的是( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
4. 下列做法正确的是( )
A. 常用水冲洗铁质品,可以防止铁质品生锈
B. 长期未用难开启的铁锁,如向锁孔中加入少量的铅笔芯粉末,就易打开
C. 用硫酸作饮用水的消毒剂
D. 蒸馒头时,向发酵的面团中加入烧碱,可中和面团中产生的酸
5. 与BaCl2溶液、Ca(OH)2溶液、CuO均能发生反应的是( )
A. Na2CO3溶液 B. Na2SO4溶液 C. 浓盐酸 D. 稀硫酸
6. 日常生活中人们常喝纯净水,市场上出售的纯净水有一些是蒸馏水,对于这一类纯净水的下列说法正确的是()
A. 它能导电
B. 它含有人体所需要的矿物质和多种微量元素
C. 它的pH=0
D. 它清洁、纯净,但长期饮用对健康无益
7. 分别将下列各组物质,同时加到足量水中,能得到无色透明的溶液是()
A. HNO3、KOH、FeCl3 B. K2SO4、KCl、HCl
C. AgNO3、HCl、KCl D. Na2CO3、KCl、BaCl2
8. 将某种含有O2、CO、CO2、N2、H2的混合气体依次通过炽热的焦炭、澄清的石灰水,灼热的氧化铜,最后经无水氯化钙干燥(设每通过一种物质参加反应的气体都完全反应),最终得到的气体是()
A. N2和CO B. N2和H2 C. N2 D. CO2和N2
9. 图1表示镁、锌、铁分别投入足量的硫酸铜溶液中,金属溶解的质量(x轴)与析出铜的质量,则表示铁与析出铜的质量关系的是()
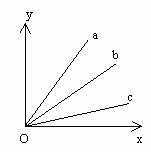
图1
A. a B. b C. c D. 无法确定
10. 下列各组物质能大量共存在同一溶液中的是( )
A. KOH和HNO3 B. CuCl2和NaOH
C. NaCl和Ca(NO3)2 D. Na2CO3和H2SO4
11. 某物质中只含有一种元素,则该物质( )
A. 一定是单质 B. 一定是混合物
C. 一定是纯净物 D. 一定不是化合物
12. 下列实验方案中,能达到预期目的是( )
A. 用NaOH溶液除去CO2中混有的HCl气体
B. 用点燃的方法除去CO中混有的少量CO2
C. 用稀盐酸除去热水瓶胆壁上的水垢(主要成分是碳酸钙和氢氧化镁)
D. 用BaCl2溶液除去KNO3溶液中混入的少量K2SO4,得到纯净的KNO3溶液
13. 医院给病人输氧时用到类如下图所示的装置,关于该装置,下列说法不正确的是()
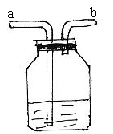
A. b导管连接供给氧气的钢瓶
B. b导管连接病人吸氧气的塑料管
C. 使用该装置用来观测是否有氧气输出
D. 使用该装置用来观测氧气输出的速率
14. 下列各组物质中,加水充分溶解后过滤,滤纸上肯定有两种不溶物的是()
A. CaCl2、Ca(NO3)2、Na2CO3 B. CuSO4、Cu(NO3)2、Ba(OH)2
C. MgCl2、Mg(NO3)2、Ba(OH)2 D. Al、AgNO3、CuSO4
15. 在反应X+2Y=R+2M中,当1.6g X与Y完全反应后,生成4.4g R,且反应生成的R和M的质量之比为11:9,则在此反应中Y和M的质量之比是( )
A. 23:9 B. 16:9 C. 32:9 D. 46:9
16. 某硫酸溶液中,氢离子与水分子的个数比为1:5,则溶液中溶质的质量分数为()
A. 20% B. 33% C. 52% D. 29%
二. 选择题(每题各有一个或两个正确选项。本题共8小题,每题2分,共16分。)
17. 在下列溶液中分别放入锌片,一段时间把锌片取出。溶液质量增加的是()
A. 氯化镁溶液 B. 盐酸
C. 硫酸亚铁溶液 D. 硝酸银溶液
18. 下图所示的锥形瓶内充满气体X,胶头滴管内盛有液体Y,挤压胶头滴管,使液体Y进入瓶中,振荡,一会儿可见套在玻璃管下端的小气球a鼓起,气体X和液体Y可能是()
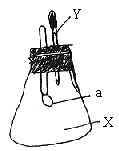
A. X是CO2,Y是KOH溶液
B. X是O2,Y是稀硫酸
C. X是HCl,Y是AgNO3溶液
D. X是CO,Y是石灰水
19. 由两种气体组成的混合气体M通过灼热的氧化铜后,氧化铜由黑色变为亮红色,剩余气体依次通过白色的无水硫铜和澄清的石灰水后,前者显蓝色,后者变浑浊,则M的组成
A. 一定是氢气与一氧化碳的混合气体
B. 一定是氢气与二氧化碳的混合气体
C. 可能是水蒸气与二氧化碳的混合气体
D. 可能是一氧化碳与氢气的混合气体
20. 下列各组物质的溶液中,不用其他任何试剂就能鉴别出来的是( )
A. MgCl2、NaOH、HCl、KCl
B. KCl、Ba(NO3)2、KOH、HNO3
C. CuSO4、NaCl、NaNO3、BaCl2
D. BaCl2、Na2SO4、Na2CO3、HCl
21. 下列有关溶液的错误说法是( )
A. 碘酒中的溶质是酒精
B. 改变条件、饱和溶液与不饱和溶液可相互转化
C. 氢氧化钙的饱和溶液一定是浓溶液
D. 析出晶体后的溶液是该温度下的饱和溶液
22. 在a、b两个烧杯内分别盛有等质量且质量分数相同的稀硫酸,现有两片质量相等的锌片,将其中一片放入a烧杯内,另一片先煅烧成氧化锌后再放入b烧杯内,过一会儿两烧杯内的固体都完全溶解,此时()
A. a、b两烧杯中硫酸锌的质量相等
B. a烧杯溶液中硫酸锌的质量分数大
C. b烧杯溶液中硫酸锌的质量大
D. b烧杯溶液中硫酸锌的质量分数大
23. 有40g质量分数为50%的CaCl2溶液,若将其质量分数增大到10%,应采用的方法是
A. 把溶剂蒸发掉一半
B. 加入40g溶质质量分数为15%的CaCl2溶液
C. 把溶剂蒸发掉20g
D. 加入2g CaCl2固体
24. CO和O2的混合气体48g,在一定条件下充分反应后,生成44g CO2,则原混合体中CO和O2的质量比可能是
A. 2:1 B. 7:4 C. 7:5 D. 7:8
第二卷(非选择题共48分)
三. 填空题(25题4分,26题8分,27题3分,28题2分,共17分。)
25. 在“淀粉、不锈钢、食盐、尿素、甲烷、熟石灰、石墨、羊毛”中选用适当的物质填空:
(1)我国实行“西气东输”工程所运输的气体是____________;
(2)用于农作物肥料的是________________;
(3)用于改良酸性土壤的是_________________;
(4)用于调味品和防腐剂的是____________________;
(5)大米、面粉中的主要物质是___________________;
(6)可作电极材料的是________________________;
(7)可用于制造炊具的是__________________;
(8)用于编织布料的是_________________;
26. 根据下列条件,写出有关反应的化学方程式。
(1)电解水________________________________________
(2)镁在氧气中燃烧_______________________________________
(3)用一氧化碳和铁矿石(主要成分Fe2O3)在高温条件下炼铁
___________________________________________________________
(4)煅烧石灰石________________________________
27. 地球大气层表面的臭氧层可以吸收太阳辐射的紫外线,对维持地球上的生态平衡有重要的作用。科学家测得臭氧(由氧元素组成的单质)的相对分子质量为48,则臭氧的化学式为_______________,相同分子数的氧气和臭氧的质量比为_________________,相同质量的氧气和臭氧的分子数之比为__________________。
28. 今年5月,一辆运载约40吨苯的罐装货车在我市某地发生翻车泄漏事故。消防官兵接警后,迅速赶到现场,将浮在水面和地面的苯打捞上来,并进行了焚烧处理,成功地化解了一场灾难。
请从上面的叙述中归纳出苯的相关性质:
(1)物理性质:______________________________
(2)化学性质:______________________________
四. 简答题(29题3分,30题3分,31题3分,共9分。)
29. 某园林工人配制波尔多液时,将胆矾(CuSO4·5H2O)晶体,生石灰(CaO)分别与水按1:50的质量比混合(胆矾溶于水,得到CuSO4溶液),然后把得到的两种液体在木桶里混合并充分搅拌。
(1)配制波尔多液不用铁桶的原因是___________________________
(2)两种液体在木桶里反应的化学方程式___________________________
(3)若要检验所配的波尔多液中是否还含有CuSO4,实现方法是____________________________________。
30. 某次考试命题留下很多稿纸,要集中销毁。销毁的方法很多。通常是由2~3人将它们烧掉。为了快速、充分地烧掉这些稿纸,最简单的操作方法是怎样的?其原理(理由)是什么?简述用燃烧的方法销毁保密资料的优缺点。
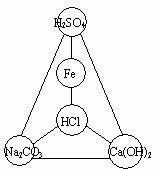
31. 选择初中化学中常见物质填入图所示的圆圈内,使图中直线相连的物质间能发生化学反应。
(1)将所选物质的化学式填入圆圈内。
(2)任意写出其中至少二个不同类型反应的化学方程式,并注明反应类型。
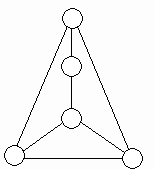
①___________________
②___________________
③___________________
五. 实验题(32题3分,33题8分,34题3分,共14分。)
32. (3分)某氢气样品中,混有少量水蒸气及氯化氢气体。若要求:(1)证明混有这两种气体;(2)除去这两种气体并确认氯化氢已除尽。请根据图5提供的装置(每种装置均有若干个)设计一个连续实验,并回答问题:
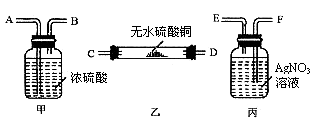
图5
(1)用接口字母表示装置连接的顺序:不纯的氢气→_________→纯净的氢气。
(2)甲装置的作用:________________
(3)丙装置的作用:________________
33. (8分)某学生为了测定由两种元素形成的化合物X的组成(该气体的水溶液呈酸性,且该气体有还原性),按图6所示装置进行实验。
把气体X由注射器A缓慢地送入装有CuO的B装置,使之完全反应,得到如下结果:
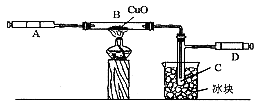
图6
(1)实验前,B管及CuO的质量为21.32g;实验后,B管及残留固体物质的质量为21.16g。
(2)C试管中收集到的物质经过电解可得到H2和O2,在D注射器中收集到的是N2。
(3)经分析知道,X中两元素的质量比为14:3。
回答下列问题:
(1)C管中收集到的液体的化学式是___________,该物质电解的化学方程式为:_________________________。
(2)B管中的现象为:_______________________。
(3)B管反应前后减轻的质量为_________________g,这部分的质量是CuO失去的_______________元素的质量,可推知跟该元素结合的另一元素(写元素符号)______________的质量为_______________g。
(4)化合物X的化学式为__________________。
(5)X与CuO共热时反应的化学方程式为______________________。
34. 氯化钠样品中混有少量碳酸钠,某学生欲用下面两种方法进行提纯。
方法一:样品溶于蒸馏水,加稍过量的盐酸,蒸干溶液。
方法二:样品溶于蒸馏水,加稍过量的石灰水,过滤向滤液中加稍过量的盐酸,蒸干溶液。
你认为这两种方法中_____________不合适,理由是________________。
六. 计算题(第35题5分,第36题7分,共12分)
35. 某金属氧化物R2O能与水反应生成ROH,已知在R2O中的R元素与氧元素的质量比为23:8。现将质量为m的水加到6.2g该金属氧化物中,得到溶质质量分数为16%的溶液。试求:
(1)该金属元素R的相对原子质量。
(2)加到该金属氧化物中水的质量m。
36. 称取氯化钠和氯化钙的固体混合物14g,放入烧杯中。加入96克碳酸钠溶液恰好完全反应(反应的方程式为:![]() ),待反应完全后过滤称得滤液的总质量为100g。
),待反应完全后过滤称得滤液的总质量为100g。
(1)根据质量守恒定律,可知生成的沉淀质量为__________________
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
【试题答案】
一. 选择题
1. C 2. C 3. C 4. B 5. D 6. D 7. B
8. A 9. B 10. C 11. D 12. C 13. A 14. B
15. B 16. B
二. 选择题
17. BC 18. AC 19. D 20. D 21. AC
22. AB 23. BC 24. AC
三. 填空题
25. (1)甲烷;(2)尿素;(3)熟石灰;(4)食盐;(5)淀粉;(6)石墨;(7)不锈钢;(8)羊毛
26. (1)![]()
(2)![]()
(3)![]()
(4)![]()
27. O3 3:2 3:2
28. (1)不溶于水;(2)可燃性,有毒性
四. 简答题
29. (1)铁能与硫酸铜发生置换反应,或![]()
(2)![]()
(3)将一根光亮的铁丝插入波尔多液中,观察铁丝表面是否变红。
30. 在燃烧过程中每隔一段时间用棒类物品挑动燃烧的纸堆(或将稿纸分散摊开同时燃烧,或边烧边添加)其原理是:给稿纸燃烧提供足够的氧气(或使燃烧过程不缺氧)这种方法的优点是操作简单、方便,成本低等;缺点是造成浪费和环境污染。
31. (1)
 或
或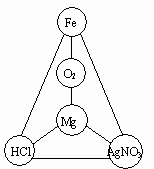
(2)①![]() 置换反应
置换反应
②![]() 复分解
复分解
③![]() 化合反应
化合反应
32. (1)CDFE FE AB
(2)除去水蒸气
(3)证明氢气中有氯化氢气体;除去氯化氢气体,验证氯化氢是否除尽
33. (1)H2O
![]()
(2)黑色粉末变成亮红色固体
(3)0.16 氧 H 0.02
(4)NH3
(5)![]()
34. 方法二不合适,理由是引起杂质![]()
六. 计算
35. (1)23;(2)43.8g
36. (1)10g;(2)11.1g;(3)14.6%