![]()
 初三化学第二次统测试卷
初三化学第二次统测试卷
| 考生 须知 | 1.本试卷分为第Ⅰ卷和第Ⅱ卷两部分,共8页。满分80分,考试时间100分钟。 2.考生要认真填写密封线内的班级、姓名、学号、考号等信息。 3.第Ⅰ卷在机读答题卡上作答。第Ⅱ卷须用黑色或蓝色钢笔、圆珠笔,字迹要工 整,卷面要整洁。 |
可能用到的相对原子质量:H-1 C-12 N-14 0-16 F-19 S-32 P-31
Cl-35.5 Na-23 Mg-24 Al-27 K-39 Ca-40 Mn – 55 Zn-65
部分碱和盐的溶解性表(20℃)
|
| Ba2+ | Ca2+ | Mg2+ | Zn2+ | Fe2+ | Cu2+ | Ag+ |
| OH– | 溶 | 微 | 不 | 不 | 不 | 不 | —— |
| SO42– | 不 | 微 | 溶 | 溶 | 溶 | 溶 | 微 |
| CO32– | 不 | 不 | 微 | 不 | 不 | 不 | 不 |
| Cl– | 溶 | 溶 | 溶 | 溶 | 溶 | 溶 | 不 |
第Ⅰ卷 (共30分)
一、 选择题(每小题只有1个选项符合题意。共30个小题,每小题1分,共30分。)
1.物质是变化的,我们生活在多姿多彩的物质世界里。下列变化中没有新物质生成的是
A.白雪缓慢消融 B.葡萄酿成红酒
C.石蕊遇碱变蓝 D.铜器锈蚀变绿
2.下列物质的用途只与其物理性质有关的是
A.干冰可作致冷剂用于人工降雨 B.氢气可作清洁燃料
C.食醋可除去水壶中的水垢 D.熟石灰可用于改良本性土壤
3.我市去年空气质量汇总结果显示,I级天数首次超过200天。为继续改善空气质量,下列措施不可行的是
A.继续动员全市人民植树增绿 B.积极推广清洁能源和清洁生产
C.鼓励发电厂多烧原煤发电 D.加强机动车管理,减少尾气污染
4.下列物质属于纯净物的是
A.清新的空气 B.冰红茶 C. 干冰 D.矿泉水

![]() 5.我国具有自主知识产权的“龙芯”计算机芯片,其核心部件是以高纯硅单质制成的,用化学方法制备高纯硅的反应原理是:SiCl4+2H2
Si + 4HCl,该反应属于
5.我国具有自主知识产权的“龙芯”计算机芯片,其核心部件是以高纯硅单质制成的,用化学方法制备高纯硅的反应原理是:SiCl4+2H2
Si + 4HCl,该反应属于
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
6.下列说法合理的是
A.由于汽油分子的质量容易变小,汽油很容易挥发;
B.矿石可以被粉碎,验证了分子可以再分的事实;
C.一定体积的水和酒精混合时,它们分子的体积发生了改变,因此体积不能加和;
D.一滴红墨水滴入一杯水中,整杯水慢慢变红,说明分子在不断进行运动.
 7. 从元素周期表中查到组成食盐的元素,对其认识正确的是
7. 从元素周期表中查到组成食盐的元素,对其认识正确的是
A.两元素组成的食盐的相对分子质量是28
B.两元素的本质不同在于中子数不同
C.两元素原子的最外层电子数之和为28

![]()
D.两元素的原子结构可分别示意为 和
8.下列作法会导致食品对人体健康有害的是
A.用干冰保藏易变质的熟食 B. 用纯碱或小苏打作蒸馒头的疏松剂
C.用甲醛浸泡易腐烂的肉类生食 D. 用聚乙烯薄膜包装食品
9.据报道,今年5月广东某金矿发生毒气熏人致死事故,经测定该毒气中含有一氧化碳、二氧化硫、氰化物等。其中一氧化碳、二氧化硫都属于
A.氧化物 B.酸 C.碱 D.盐
![]() 10.镍氢电池是近年开发出来的可充电电池,它可以取代产生镉污染的镉镍电池,镍氢电池的总反应式为:2NiO(OH) + H2 2Ni(OH)2。则Ni(OH)2中Ni元素的化合价为
10.镍氢电池是近年开发出来的可充电电池,它可以取代产生镉污染的镉镍电池,镍氢电池的总反应式为:2NiO(OH) + H2 2Ni(OH)2。则Ni(OH)2中Ni元素的化合价为
A.+1 B.+2 C.+3 D. +4
11. “南水北调”丰富了北方的水资源。为保护好来之不易的水资源,下列做法正确的是
A.大量使用含磷洗衣粉 B. 农业耕种需合理使用农药、化肥
C.将生活垃圾丢入河道 D. 无色透明工业废水可直接排放
12. 下列图示实验基本操作正确的是
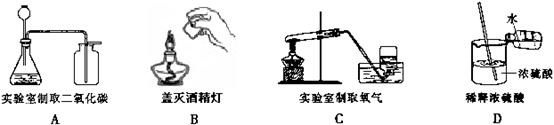 |
13.下列物质发生的变化与空气的成分无关的是
A.钢铁在空气中生锈 B.生石灰在空气中变质
C.烧碱固体在空气中潮解、变质 D.盐酸敞口放置在空气中质量减少
14. 下列有关实验现象的描述正确的是
A.棉花在酒精灯的火焰上灼烧后会产生烧焦羽毛味
B.红磷在空气中燃烧,产生大量白雾
C.铁丝在氧气中燃烧火星四射,放出大量的热,同时生成黑色固体
D.把银片浸入硫酸铜溶液一段时间后取出,银片表面覆盖一层红色物质
15. 生活中的下列做法科学的是
A.用聚氯乙烯塑料袋包装食品 B.电器设备着火用水浇灭
C.尽量选择合成纤维类布料缝制贴身衣物 D.洗涤剂作乳化剂,用来清除油污
16.下列化学用语中,书写正确的是
A.硫酸铝 AlSO4 B.氧化铁FeO C.五氧化二磷P2O5 D.2个氢原子H2
17. 一种名为苹果醋的浓缩饮料多年来风靡美国,苹果酸(C4H605)是其中的主要物质之一。下列说法中错误的是
A.苹果醋饮料呈酸性 B.苹果酸不属于氧化物
C.苹果酸属于无机化合物 D.苹果酸属于有机物
![]() 18.已知:
分别代表不同种元素的原子,当两种物质在一定条件下能发生化学反应,用微观示意图表示为:
18.已知:
分别代表不同种元素的原子,当两种物质在一定条件下能发生化学反应,用微观示意图表示为:

则下列说法正确的是
A.图示中的反应物都是单质 B.图示中共有3种化合物分子
C.该反应属于置换反应 D.该图示不含有非金属元素原子
19. 下列化学方程式与事实相符且正确的是
A.洗去试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑
B.用铁和硫酸铜溶液反应制备铜:Fe+CuSO4===Cu+FeSO4
C.用一氧化碳还原氧化铁炼铁:Fe2O3+CO高温 2Fe+CO2
D.用氢氧化镁治疗胃酸过多症:2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O
20. 牙膏里添加的单氟磷酸钠[Na2PO3F]可有效预防龋齿,关于单氟磷酸钠的说法正确的是
A.它是由钠、磷、氧、氟4个原子构成
B.它是由钠、磷、氧、氟4种元素组成的混合物
C.单氟磷酸钠中钠、磷、氧、氟元素的质量比为2:1:3:1
D.单氟磷酸钠中磷元素的化合价为+5价
21.下表是小明制定的食谱单,为使营养均衡,在“你的补充”栏可以选填的食物是
| 主食 | 米饭、馒头 | 饮料 | 牛奶 |
| 副食 | 烧鸡块、咸鸭蛋、红烧鱼、花生米 | 你的补充 |
A.凉拌黄瓜 B.糖醋鱼 C.熊掌豆腐 D.蛋糕
22.人类的生活和生产都离不开金属。下面对金属的利用不是由金属活动性决定的是
A.用铁回收含银废液中的银 B.用锌与稀硫酸反应制取氢气
C.古代金银制品能保存至今 D.用铝合金制作门窗框架
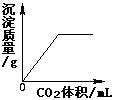
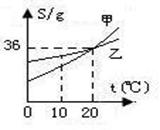 23.右图为甲、乙两种物质的溶解度曲线。下列说法错误的是
23.右图为甲、乙两种物质的溶解度曲线。下列说法错误的是
A.甲的溶解度受温度影响比乙大
B.10℃时,甲的溶解度小于乙的溶解度
C.20℃时,100g甲的饱和溶液中含有36g甲
D.20℃时,甲、乙的饱和溶液具有相同的溶质质量分数
24.下列方框内是对某一主题知识的描述.其内容全部正确的一组是
A. 安全常识 B.环保常识
| 安装燃气热水器---------定要配有烟道 预防煤气中毒-----------室内放一盆水 劣质装饰材料---甲醛等超标致室内污染 | 减少汽车尾气污染------使用乙醇汽油 深埋丢弃废旧电池------造成水土污染 大理石雕塑被腐蚀------温室效应所致 |
C. 健康常识 D.生产常识
| 食用水果蔬菜-----------可补充维生素 食用“加铁酱油”---------可预防贫血 食用加碘盐---------可预防甲状腺肿大 | 氮气----------可做焊接金属的保护气 K2CO3 ---------------- 可作复合肥料 油罐车尾铁链--------防静电引燃油料 |
25.某同学从资料上获悉,一些紫色的叶或花瓣浸出液具有类似石蕊试液的性质。如果他想知道紫色喇叭花是否具有这种性质,应把花瓣浸出液分别滴入下列哪组物质进行观察
A.食醋、石灰水 B.食醋、酸奶
C.糖水、酸奶 D.食醋、食盐水
26.在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲得到的产物,即原子的利用率为100% ,从根本上减少乃至杜绝污染。在催化剂作用下,如果用丙炔(C3H4)合成2-甲基丙烯酸甲酯(C5H8O2),欲按照“绿色化学” 要求,还需要的其他反应物是
A.CO2和CH3OH B.CO2和H2 C.H2和CO D.CH3OH
27.区别以下各组物质的方法错误的是
A.刻划法区别有机玻璃和普通无色玻璃 B.燃烧法区别棉线和羊毛线
C.用酚酞试液区别稀盐酸和氯化钠溶液 D.用肥皂水区别软水和硬水
28.下列除杂的实验过程都正确的是(括号内为杂质)
A.MnO2 (KCl) 加水溶解、过滤、洗涤、干燥
B.NaOH(Na2CO3) 加适量HCl溶液、干燥
C.CuSO4(FeSO4) 加足量Cu、过滤、洗涤、蒸发
D.KCl(K2CO3) 加适量Ca(OH)2溶液、过滤、蒸发
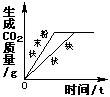
29.下列图像不能正确反映其对应操作的是
| A | B | C | D |
|
|
|
|
|
| 在一定量的CaCl2溶液中通入CO2气体 | 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 | 向NaOH溶液中逐滴加入稀盐酸 | 等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应 |
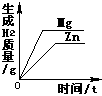
30.锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为
A.0.15g B.0.20g C.0.30g D.0.45g
第Ⅱ卷(非选择题 共50分)
 二、填空题(31~35小题,共26分)
二、填空题(31~35小题,共26分)
31.(7分)科技推动着奥林匹克运动的发展,化学的表现十分突出。
![]() (1)右图:“鸟巢”的建造中使用了大量的钢铁。生产这些钢铁时首先要将铁矿石(Fe2O3)在高温下用一氧化碳还原成生铁,其化学方程式为
;“水立方”的膜结构是由化学合成材料ETFT制成的,其化学式是(C2H2F2)n ,则其相对分子质量的计算式是
。
(1)右图:“鸟巢”的建造中使用了大量的钢铁。生产这些钢铁时首先要将铁矿石(Fe2O3)在高温下用一氧化碳还原成生铁,其化学方程式为
;“水立方”的膜结构是由化学合成材料ETFT制成的,其化学式是(C2H2F2)n ,则其相对分子质量的计算式是
。
(2)奥运参赛者不断利用新科技成果助推其实现“更高、更快、更强”。
 如图:
如图:
连体紧身泳装“快皮” “红色魔鞋”及碳纤维 玻璃纤维杆
①撑杆跳高用上是玻璃纤维杆,使撑杆跳高纪录得以腾飞。玻璃纤维主要组成成分是SiO2、Al2O3等,在物质分类中他们属于 。
A.单质 B. 化合物 C. 有机物 D. 无机物 E. 氧化物
②连体紧身泳装快皮的面料为一种特细尼龙,具有延展性强,吸水率极低,水的阻力小,质量轻、速度快的特点。关于快皮的面料所述的特点在化学中属于 。
A.物理性质 B. 化学性质
③耐克公司为刘翔参加奥运会专门制做的跑鞋人称“红色魔鞋”,其良好的性能主要是因为它使用了一种叫做碳纤维的制作材料。将普通有机合成纤维在惰性气流中高温分解就可以得到碳纤维,则这里惰性气体的作用是 。
(3)奥运比赛对运动员食物及饮品要科学合理,对此你的建议是:
①跑、跳、投、举重、游泳等赛前应多进食 ,有利于创造好的成绩。
A.米饭及各种面食 B. 鸡蛋及各种肉类 C.水果及各种蔬菜 D. 油炸或油焖食物
②赛后要多喝些运动饮品,可做该种饮品的是 。
A.含矿物质、微量元素、维生素、糖的饮料 B. 糖水 C. 纯水 D. 啤酒
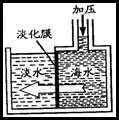 32. (6分)我国东依广阔的大海,具有丰富的海洋资源。
32. (6分)我国东依广阔的大海,具有丰富的海洋资源。
(1)我国是内陆缺水比较严重的国家,将丰富的海水经过淡化膜处理既
可以得到淡水输往内陆,以解决工业和生活用水困难。该过程是通
过 变化实现的。
(2)海低蕴藏有丰富的石油天然气资源。
①天然气燃烧用化学方程式表示为 。
②化石类资源的开采和使用,会产生大量“温室气体”,为减少“温室气体”的形成,则对海洋资源利用研究应着力于以下___ ___ _。
A. 海洋风力发电 B. 海水潮汐发电 C. 海洋地热开发 D.制氢储氢系列
(3)通过晒海水可以得到粗盐。粗盐中含有泥沙、氯化钙等杂质,可通过下列步骤制取精盐:
a → 加过量的Na2CO3溶液 → b → 加适量的盐酸 → c
①操作a、b、c中均使用的仪器是 。
②加过量Na2CO3的作用,用化学方程式表示为: ;
③加适量的盐酸的目的,用化学方程式表示为: .
33.(4分)现在市场上食品保鲜的方式多种多样。
①一类做法是直接在食品中添加防腐剂,其中山梨酸钾(化学式为C6H7O2K)是常用的一种,山梨酸钾中碳、氢、氧、钾元素的原子个数比是 。
②另一类做法是对那些易受挤压破碎的小食品充填保护气体,其中氮气是首选,其目的是 。
③第三类做法是放置脱氧保鲜剂,当打开食品包装袋后,里面常见标有“禁止食用” 字样的一小纸包物质,将纸包里黑色物质倒入盛有盐酸的试管内,产生气泡,该纸包里最初所装入的估计是 。
④用PE塑料保鲜膜包裹,是对新鲜蔬菜及水果保鲜广泛使用的做法。保鲜膜具有调节内外O2、CO2平衡和保留内部果蔬水分的作用,这一现象说明的微观事实是______ _ ___。
34.(5分)用如图所示装置进行实验:
(1)当打开止水夹,挤压滴管将液体A滴入试管①时,观察到试管②有气泡产生。
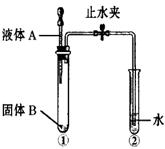 ①若固体B来源于饮料罐,写出一合理的化学反应方程式:
①若固体B来源于饮料罐,写出一合理的化学反应方程式:
。
②若固体B来源于废电池,且发生分解反应,写出一合理的
化学反应方程式: 。
③若液体A遇固体B发生化合反应,写出一合理的化学反应
方程式: 。
④若固体B来源于厨房用品,写出一合理的化学反应方程式:
。
(2)当打开止水夹,挤压滴管将液体A滴入试管①时,观察到试
管②中的水慢慢被倒吸于导气管内一段,固体B可做化肥,固体B是 。
35.(4分)如图已知A、B、C、D、E、F为六种常见化合物相互反
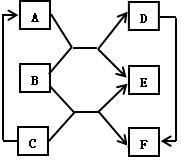 应及转化关系,B通常为无色气体,E通常为无色液体,请回答:
应及转化关系,B通常为无色气体,E通常为无色液体,请回答:
(1)B的化学式为 ;
(2)D的俗称是 ;
(3)B与C反应生成E和F的化学方程式:
;
(4)C → A反应的化学方程式:
。
三、实验题(36~38小题,共18分)
36.(6分) 结合下列实验装置图回答问题:
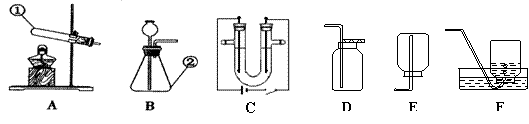 |
(1)写出指定仪器的名称:① ②
(2)实验室中通常可用 装置制得氧气,可用 装置收集氧气。
写出用高锰酸钾制氧气的化学方程式: 。
(3)实验室制取二氧化碳时,可选用的装置是 。
37.(6分)铁暴露在空气中会生锈。切开的苹果放置不久,果肉上也会产生一层咖啡色的物质,也好象是生了“锈”一样。某化学活动组对此进行了探究。
【提出问题】切开的苹果“生锈”与什么因素有关?
【猜想与假设】
猜想①:可能与空气没有关系,只是果肉内的物质自身相互反应而“生锈”。
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”;
猜想③:可能是果肉中的物质与空气中的氮气作用而“生锈”;
猜想④:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”;
猜想⑤:可能果肉中的物质与空气作用而“生锈”的速度还与温度有关。
【查阅资料】 苹果果肉里的物质(酚和酶)与空气接触发生反应,生成咖啡色的物质。
【实验探究】针对以上猜想,活动组认为实际上可以排除 。但他们仍对所有猜想设计了如下图所示的实验方案进行了验证,并观察到实验现象。
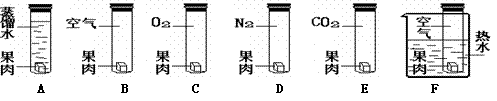
请你完成下表中空余部分。
| 猜想 | 实验设计及装置 | 观察到的实验现象 |
| 猜想① | A | 果肉表面不变色 |
| 猜想② | C |
|
| 猜想③ | D | 果肉表面不变色 |
| 猜想④ | E |
|
| 猜想⑤ |
| 温度高的先变色。 |
【得出结论】苹果果肉里的物质(酚和酶)与空气中氧气发生了反应,生成咖啡色的物质。
【反思与评价】在验证猜想①时,同学们发现,如果水不与空气隔绝,果肉放在水中时间长了也会变色,其原因是 。
【应用】根据上述结论,要防止果汁变质,加工和保存果汁时可采取的措施是:
。
38.(6分)某同学对盐酸溶液与氢氧化钠溶液的反应,按下图所示过程进行探究:
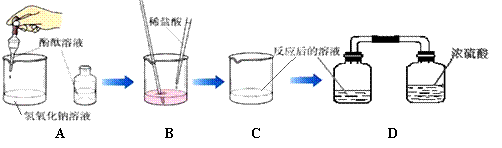
(1)填充实验过程空格项:
| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 | |
| 步骤① | 取适量NaOH溶液放入烧杯中,滴入几滴酚酞试液。 |
。 |
|
| 步骤② | 用胶头滴管将稀盐酸慢慢逐滴滴入到步骤①所得的溶液中, 。 |
溶液颜色逐渐变浅直至到无色。 | 氢氧化钠与稀盐酸反应。 |
| 步骤③ | 当滴加稀盐酸至发生上述现象出现,立即停止。 |
|
|
| 步骤④ | 将③所得溶液移入广口瓶,并与盛有浓硫酸的广口瓶用导管连接导通,放置一段时间。 | 。 | 。 |
(2)模型探究:对上述过程采用微观模型加以认识,如下图:
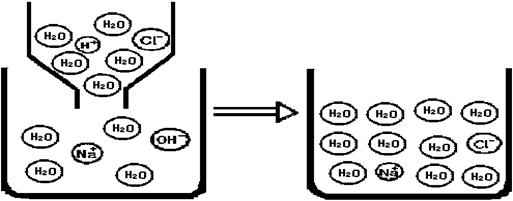 |
①.氢氧化钠溶液与盐酸反应。反应中消失的离子有:
②.上图微观模型所反映的NaCl溶液溶质的质量分数:
四、计算题(39~40小题,共6分)
39.镁条在空气中易被氧化,有一根在空气中放置一段时间的镁条样品,其质量为2.56g,把该样品与足量的稀硫酸反应得到氢气0.18g。请计算:
(1)样品中未被氧化的镁的质量是多少?
(2)该镁条未被氧化时的质量是多少?
40.某学校的学习小组对当地的石灰石矿区进行调查,欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 11 | 6 | 2.8 | n |
根据实验数据计算:
(1)表中n的数值为 。
(2)样品中碳酸钙的质量分数是 。
(3)盐酸中溶质的质量分数 。
房山区2008学年初三化学第二次统测试卷参考答案
一、选择题(每小题1分,共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | A | C | C | C | D | D | C | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | D | C | D | C | C | B | B | D |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | A | D | C | C | A | C | C | A | A | A |
二、填空题(每空1分,共26分)
31.(7分)(1) Fe2O3+3CO高温 2Fe+3CO2 ; (12 + 1×2 +19×2) ×n
(2) ① B 、D 、E ; ② A ; ③ 隔绝空气做保护气
(3)① A ; ② A
![]() 32.(6分)(1)物理变化
32.(6分)(1)物理变化
(2)① CH4 + 2O2 CO2 + 2H2O
②A、B、C、D
![]() (3)① 玻璃棒
(3)① 玻璃棒
![]() ② CaCl2 + Na2CO3 CaCO3
↓ +
2NaCl
② CaCl2 + Na2CO3 CaCO3
↓ +
2NaCl
③ Na2CO3 + 2HCl 2NaCl + H2O + CO2 ↑
33.(4分) ① 6:7:2:1
② 防食品被氧化和挤压破碎
③ 铁粉
④ 相同条件时,气体分子比液态物质分子运动的快
![]()
![]() 34.(5分)(1)① 2Al +
6HCl
2AlCl3 + 3H2 ↑(写H2SO4也可)
34.(5分)(1)① 2Al +
6HCl
2AlCl3 + 3H2 ↑(写H2SO4也可)
② 2H2O 2H2O + O2 ↑
![]() ③ CaO + H2O Ca(OH)2
③ CaO + H2O Ca(OH)2
![]() ④ NaHCO3 + HCl NaCl
+ H2O + CO2 ↑
④ NaHCO3 + HCl NaCl
+ H2O + CO2 ↑
(2) NH4NO3
35.(4分)(1) CO2
(2) 纯碱
![]()
![]() (3) Ca(OH)2 + CO2
CaCO3↓+
H2O
(3) Ca(OH)2 + CO2
CaCO3↓+
H2O
(4) Ca(OH)2 + Na2CO3 CaCO3↓+ 2NaOH
三、实验题(共18分)
![]() 36. (6分)(1) ①试管 ②锥形瓶
36. (6分)(1) ①试管 ②锥形瓶
(2)A、B ;D、F ;2KMnO4 K2MnO4 + MnO2 + O2 ↑
(3)B、D
37. (6分)【查阅资料】①
请你完成下表中空余部分。
| 猜想 | 实验设计及装置 | 观察到的实验现象 |
| 猜想② | 果肉表面出现咖啡色 | |
| 猜想④ | 果肉表面未出现咖啡色 | |
| 猜想⑤ | B、F |
【反思与评价】氧气溶于水,会慢慢氧化果肉。
【应用】使用保护气和煮沸过的凉水,保存时加保护气或抽出空气且密闭。
38.(6分) (1)填充实验过程空格项:
| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 | |
| 步骤① | 溶液变红 。 |
| |
| 步骤② | 边加边搅拌 。 |
| |
| 步骤③ |
|
| |
| 步骤④ | 有无色晶体析出 。 | 浓硫酸有吸水性。 | |
(3)总结:A. H+ 、OH-
B. 25%
四、计算题(共6分)
![]() 39. (1)解:设样品未被氧化的镁的质量为X
39. (1)解:设样品未被氧化的镁的质量为X
Mg + H2SO4 = MgSO4 + H2 ↑
24 2 (1分)
X 0.18g
24:2 = X:0.18g X = 2.16g
(2)解:样品MgO的质量= 2.56g – 2.16g = 0.40g (1分)

![]() 样品被氧化前的质量= 2.16g + 0.40g×
×100% = 2.40g
样品被氧化前的质量= 2.16g + 0.40g×
×100% = 2.40g
答: 略 (1分)
40.(1) 2.8 (1分)
(2) 82.5% (1分)
(3)由试题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
解:设盐酸溶液中溶质的质量分数为x。
CaCO3 + 2HCl =CaCl2+H2O+CO2↑
100 73
5g 20g· x
100∶73 = 5g∶(20g· x)
x=18.25% (1分)