八年级科学第二学期质量检测
科学 试卷 (命题人 杨赋荣)
可能用到的相对原子量:H-1 I-127 K-39 O-16 S-32 C-12 N-14 Na-23 Fe-56 Cu-64 Li-3 Cl-35.5
一、我来选(每题2分,共计40分)
1、分子和原子的主要区别是( ▲ )
A.分子质量大于原子质量 B.分子能运动而原子不能运动
C.原子可以构成分子 D.在化学反应中分子可以再分而原子不能再分
2、下列物质的化学式书写正确的是( ▲ )
A.氖气Ne2 B.氧化铜OCu C.氯化钠 NaCl D.硝酸钙CaNO3
3、 下列符号既表示一种元素,又表示一个原子,又能表示一种物质的是( ▲ )
A.2N B.O C.SO2 D.Ag
4、下图是四种不同物质的分子模型,图中黑白圆圈分别代表两种不同原子,则属于单质的是( ▲ )

5、1991年,我国著名化学家张青莲教授与另一位科学家合作,测定了铟(In)元素的相对原子质量的新值。铟元素的核电荷数为49,相对原子质量为115,铟原子的质子数为( ▲ )
A 115 B 49 C 66 D 164
6、在Fe、Fe2+、Fe3+三种粒子中,一定相等的是( ▲ )
A.所带电量 B.质子数 C.核外电子数 D.它们的化合价相同
7、隐型眼镜洗液的主要成分是H2O2,下列说法正确的是( ▲ )
A.H2O2是由氢气和氧气组成的 B.H2O2是由氢元素和氧元素组成的
C.H2O2是由氢分子和氧分子组成的 D.H2O2是由两个氢元素和两个氧元素构成的
8、编制第一个元素周期表的科学家是( ▲ )
A.道尔顿 B.卢瑟福 C.门捷列夫 D.汤姆森
9、道尔顿的原子学说曾经起了很大作用。他的学说中,包含下述三个论点:①原子是不能再分的粒子;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现在的观点看,你认为这三个论点中,不确切的是( ▲ )
A 只有③ B 只有①③ C 只有②③ D ①②③
10、10个H2O和10个H2SO4分子中一样多的是( ▲ )
A.氢分子个数 B.氢原子个数 C.氢元素个数 D.氢气
11、A、B、C三只集气瓶内,分别装有空气、氧气、氮气。把燃着的木条分别伸入瓶内,发现A内木条照常燃烧,B内木条燃得更旺,C内燃着的木条熄灭。由此可知,A、B、C三瓶气体依次是( ▲ )
A、空气、氧气、氮气 B、空气、氮气、氧气
C、氮气、氧气、空气 D、氮气、空气、氧气
12、卢瑟福α粒子散射实验的结果( ▲ )
A.证明了质子的存在
B.证明了原子核是由质子和中子组成的
C.证明了原子核的全部正电荷和几乎全部质量都集中在一个很小的核上
D.说明原子中的电子只能在某些不连续的轨道上运动
13、下列是计算氢氧化钙[Ca(OH)2]相对分子质量的式子,其中正确的是( ▲ )
A. 40+16+1=57 B. 40+2×(16+1)=74
C. 40×16+1=640 D. 40×2×16×1=1280
14、交警常用装备重铬酸钾(K2Cr2O7)的仪器监测司机是否酒后开车,因为酒中的乙醇分子可以使橙红色的重铬酸钾变成绿色的硫酸铬[Cr2(SO4)3],重铬酸钾和硫酸铬中的铬元素的化合价依次为( ▲ )
A. +3,+5 B.+5,+3 C.+3,+6 D.+6,+3
15、某种氮的氧化物,氮元素和氧元素的质量比为7∶20,则该化合物的化学式( ▲ )
A.N2O B.NO2 C.N2O5 D.NO
16、几年前我国部分地区突发的“非典型性肺炎”威胁着人们的身体健康,过氧乙酸可以起到消毒作用,其分子结构如图所示(注:●表示碳原子;∷表示氧原子;○表示氢原子)。下列有关过氧乙酸的叙述不正确的是( ▲ )
 A.过氧乙酸分子的化学式为C2H4O3
A.过氧乙酸分子的化学式为C2H4O3
B.其相对分子质量为76
C.C、H、O三种元素的质量比为2:4:3
D.过氧乙酸分子中含有3种原子
17、要使Fe3O4与Fe2O3含有相同质量的铁元素, 则它们的质量比为( ▲ )
A.2:3 B.1:1 C.29:30 D.42:29
18、如右图,某同学用燃烧红磷的方法测定空气中氧气的体积分数,实验后发现测得的氧气体积分数小于1/5,对此,你认为下列做法或想法不可取的是( ▲ )
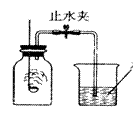 A.检查实验装置是否漏气
A.检查实验装置是否漏气
B.可能红磷的量不足,没有除尽氧气
C.将红磷改成足量的木炭,重新实验
D. 没有冷却至室温就打开止水夹,进入瓶内的水减少
19、硫酸亚铁(FeSO4)可治疗缺铁性贫血,某贫血患者每天需补充1.12克铁元素,则他服用的药物中含硫酸亚铁的质量至少为( ▲ )
A、3.80克 B、6.95克 C、10克 D、3.04克
20、作为相对原子质量标准的碳-12可以写成12C 。1个12C的原子的质量为a千克,1个12CO2分子的质量为b千克,若以12CO2分子中的1个氧原子质量的`1/16作为相对原子质量的标准,则12CO2的式量是( ▲ )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
二、我会填(每空1分,共计24分)
21、科学研究证明,物质是由微粒构成的,例如铁是由铁原子构成的。请填写构成下列物质的具体微粒的名称:
⑴体温计中的汞(又称:水银)是由 ▲ 构成的;
⑵用于人工降雨的干冰是由 ▲ 构成的;
⑶用于配制生理盐水的氯化钠是由 ▲ 构成的。
22、用符号或化学式表示:
(!)2个氯原子 ▲ (2) 3个镁离子 ▲ (3) 4个水分子 ▲
(4)3个碳酸根离子 ▲ (5)氦气 ▲ (6)五氧化二磷 ▲
(7)氧化铝 ▲ (8) 硫化锌 ▲ (9) 氯化铜 ▲
23、写出3SO42-中有关数字表示的意义:
“2” ▲ “3” ▲
24、一氧化氮会造成大气污染,可它在人体中有独特的功能。有三位科学家由于对一氧化氮的研究所取得的医学成果,获得1998年度诺贝尔医学奖。一氧化氮也被誉为“明星分子”。请写出一氧化氮的化学式 ▲ ,相对分子质量是 ▲
25、海洛因是我国政府明令严禁的毒品,其化学式为C21H23NO5,它由 ▲ 种元素组成,每个分子中共有 ▲ 个原子。
26、原子的质量主要集中在 ▲ 上。原子失去电子时成为 ▲ 离子,原子得到电子时成为 ▲ 离子。氧元素有三种同位素原子,这三种原子 ▲ 数相同, 但 ▲ 数不同。
27、在①Cl2 ②Ca(ClO)2 ③KClO4 ④MgCl2 ⑤KClO3 五种物质里,按氯元素的化合价从高到低排序依次为__ ▲ ___________________
三、我会探究科学(每空2分,共计22分)
28、已知电子的质量约为质子(或中子)质量的1/1840,下表是几种原子的构成和它们的相对原子质量。
| 原子种类 | 原子核 | 核 外 电子数 | 相对原 子质量 | |
| 质子数 | 中子数 | |||
| 氢(H) | 1 | 0 | 1 | 1 |
| 氦(He) | 2 | 2 | 2 | 4 |
| 氮(N) | 7 | 7 | 7 | 14 |
| 氧(O) | 8 | 8 | 8 | 16 |
| 铁(Fe) | 26 | 30 | 26 | 56 |
通过此表可以总结出如“质子数等于核外电子数”等结论,请你再总结出二条。
⑴______________________________▲_________________________________;
⑵______________________________▲_________________________________。
29、奥运会上火炬的可燃物是丁烷(C4H10),它燃烧时火苗高而亮,在白天,两百米外也能清晰可见, 将你所知道的信息(即该化学式的涵义)至少写出三项:
⑴________▲________;⑵_______▲__________;
⑶________▲________。
30、一次实验结束时,小李忘记将酒精灯帽盖上,第二天再去点燃时,怎么也点不着,这是怎么回事呢?小李想探个究竟,于是便设计进行了下列实验:①检查灯内是否还有足量的酒精,发现酒精量充足②将灯内的酒精倒出少量点燃,能很好的燃烧③挤压灯头处的灯芯,很难挤出液体。点燃挤出的一滴液体,其不能燃烧④将灯帽盖好放置几小时后,或直接在灯头上滴几滴酒精,再去点燃时,酒精灯能正常燃烧。⑤去学校图书室查阅了有关资料,记录了如下有关的信息:
酒精(学名乙醇)是无色透明、具有特殊香味的液体。它易挥发,能与水以任意比例混溶,并能溶解多种有机化合物,实验室酒精灯所用酒精一般是95%的工业酒精, 酒精的沸点为:78℃ 水的沸点:100℃.请回答下列问题:
(1)通过实验①能得出的结论是 ▲ 。
(2)小李设计进行实验②的目的是 ▲ 。
(3)实验③挤出的一滴液体不能燃烧的可能原因是 ▲ 。
(4)通过以上探究活动,小李最终可以得出的结论是 ▲ 。
31、某研究性学习小组设计了如下图所示的装置,探究空气中氧气的体积分数,其中A是底面积为50cm2、高20 cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
a.检查装置的气密性;
b.加入水并调整B的高度,使A中的液面至刻度15 cm处;
c.将过量的铜粉平铺在惰性电热板上,盖紧密封盖;
 d.通电加热铜粉,待充分反应后,冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)
d.通电加热铜粉,待充分反应后,冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)
(1)在操作a中检查装置气密性的方法是 ▲ 。
(2)在上述实验中,下列物质不能代替铜粉的是 ▲ (填字母)。
A.红磷 B.木炭 C.铁粉
(3)在操作d结束时,装置A中液面的刻度约为 ▲ cm(填整数)。如果在操作d结束时,装置A中液面刻度在11cm处,则实验结果比理论值 ▲ 。(填“偏大”或“偏小”)。
四、我来解决问题(共计19分。32题6分,33题8分,34题为挑战题5分,可加入总分)
32、(6分)为了测定硫酸铜晶体(CuSO4·xH2O)中的结晶水的含量,做下列实验,将硫酸铜晶体放在坩埚里加热,至不含结晶水
| 物质 | 质量(克) |
| 坩埚+硫酸铜晶体 | 45.5 |
| 坩埚+无水硫酸铜 | 36.5 |
| 坩埚 | 20.5 |
测得数据见右表
⑴反应生成水 ▲ 克。
⑵硫酸铜晶体中结晶水的含量的百分比为 ▲
33、(8分)油炸食品、烧烤食品等被营养专家称作“垃圾食品”,这是因为在制作过程中不仅产生大量有害气体污染环境,而且食物中还会产生一些强致癌物质,故此类食品不宜多吃、常吃。如在食物的煎炸过程中会产生一种有害物质——丙烯醛,化学式为(C2H3CHO)。试回答:
⑴丙烯醛的相对分子质量。
⑵丙烯醛中各元素的质量比。
⑶丙烯醛中氧元素的质量分数。
⑷112克丙烯醛中碳元素的质量为多少克。
34、(5分)煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤烟中含有硫的化合物(如FeS2),燃烧时生成SO2气体还会造成环境的污染。设某个有30万户人口的中等城市,每户每天烧煤5千克,这种煤中含有5%的FeS2,燃烧时可有90%的硫转化为二氧化硫排放到大气中(同时生成氧化铁)。则:
(1)燃烧1吨这种煤可产生多少千克SO2。(3分)
(2)该中等城市如果全部用上述煤做燃料,每年将有多少吨二氧化硫排到大气中。(一年以365天计算)(2分)
科学 答案卷
一、我来选(每小题2分,共40分,每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | C | D | C | B | B | B | C | D | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | B | D | C | C | C | C | D | A |
二、我会填(本题每空1分,共24分)
21、(1)汞原子(原子) (2)二氧化碳分子(分子) (3)钠离子和氯离子(离子)
22、⑴ 2Cl ⑵ 3Mg2+ ⑶ 4H2O
⑷ 3CO42- ⑸ He ⑹ P2O5
⑺ Al2O3 ⑻ ZnS ⑼ CuCl2
23、: 1个硫酸根离子带2个单位负电荷
3个硫酸根离子
24、 NO __ 30 25、 4 ____ ___ 50 _
26、原子核__. ____阳________.___阴___.__质子数__._ ___中子数__。
27、 KClO4 KClO3_ Ca(ClO)2 _Cl2 MgCl2 __ ____
三、我会探究科学(每空2分,共22分)
28、(1) 质子数加中子数等于相对原子质量
(2) 质子数与中子数不一定相等
29、(1)表示丁烷这种物质(2)丁烷是由碳元素和氧元素组成
(3)1个丁烷分子中有4个碳原子和10个氢原子(等)
30、(1)点不着不是没有酒精造成的(不燃烧与酒精的量无关)
(2)检查酒精能否燃烧(不燃烧跟酒精无关)
(3)酒精挥发了(不是酒精)
(4)酒精易挥发(是水)(合理即可)
31、(1)往B中加水,使A、B液面保持水平,盖紧A的密封盖,再向B中加水,使B中的液面高于A,一段时间后B中液面不下降,则气密性好。(或往B中加水,使A、B液面保持水平,盖紧A的密封盖,再用手捂住A的外壁,若B中的液面上升,则气密性好。)(合理即可)
(2)___ B _______ (3)12 偏大
四、我来解决问题(共计19分。32题6分,33题8分,34题为挑战题5分,可加入总分)
32、(1) __ _9 ____ (2) ____ _ 36%_ _ ____
33、⑴ 56
⑵MC:MH:MO = 9:1:4
⑶ O% = 2O/ C2H3CHO =16/56 =28.6%
⑷MC =72克
34、(1)0.24
(2)7.2