高考理科综合试题化学学科卷
第Ⅰ卷(48分)
6.环境问题是2007年“两会”的重要议题,保护环境是公民的责任和义务。下列说法正确的是( )
A.大量使用含磷洗涤剂会带来白色污染 B.减少使用氟氯代烷的目的是为了减少酸雨
C.大量开采地下水,矿产资源,以满足社会经济发展的需求
D.氢燃料电池汽车的使用,可以有效减少城市空气污染。
7.已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。下列反应不能发生的是( )
A.(CN)2+2Br-=2CN-+Br2 B.(CN)2+C2H4→NC—CH2—CH2—CN
C. CN-+H+=HCN D.(CN)2+2OH-=CN-+CNO-+H2O
8.下列反应的离子方程式正确的是 ( )
![]()
| |
![]() B.NaHS水解:HS- + H2O H2O+
+ S2-
B.NaHS水解:HS- + H2O H2O+
+ S2-
C.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH—=NH3↑+2H2O
![]() D.澄清石灰水与少量小苏打混合:Ca2+ + OH- + HCO3- CaCO3↓+ H2O
D.澄清石灰水与少量小苏打混合:Ca2+ + OH- + HCO3- CaCO3↓+ H2O
9.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.将NO2和N2O4分子共NA的混合气,气温降至标况下,其体积为22.4L
B.7.8gNa2O2与足量水充分反应转移电子数为0.2NA
C.新戊烷与异戊烷的混合物7.2g中所含共价键为1.6NA
D.同温同压下,体积分别为11.2L的CO2和SO2混合后所含有氧原子数2NA
10.已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COONa
溶液,下列说法正确的是( )
A.CH3COONa溶液中:c
(CH3COO![]() ) c ( Na + ) >c (OH— ) >c ( H + )
) c ( Na + ) >c (OH— ) >c ( H + )
B.在相同条件,两溶液的pH大小为:CH3COONa < NaF
C.在NaF溶液中,c ( Na + )+ c ( H + ) = c (F— )+ c (OH— )
D.相同条件下,两溶液相比较,CH3COONa溶液中的离子总数较多。
11.有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。电
![]() 池的总反应为:
,负极反应为H2
+ CO32--2e- = H2O + CO2。下列说法中正确的是( )
池的总反应为:
,负极反应为H2
+ CO32--2e- = H2O + CO2。下列说法中正确的是( )
A.正极反应为4OH--4e-= 2H2O + O2↑
B.电池放电时,电池中CO32-的物质的量将逐渐减少 C.放电时CO32-向负极移动
D.电路中的电子经正极、负极、熔融的K2CO3后再转移到正极,形成闭合回路
12.下列叙述正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点越高
| |
C.位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元
素的最高化合价一定是X<Y
D.将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的相同颗粒大小的锌,产生H2的起始速率相同,醋酸放出的氢气多
 |
13.T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B和C物质的量变化与时间关系如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是( )
A.2min内A的化学反应速率为0.1mol/L min
B.在反应达到平衡时,保持其它条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达到平衡时,保持其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.在T℃时,若A的浓度减少了1mol/L,则B的浓度会减少3mol/L,C的浓度会增加2mol/L
第Ⅱ卷(共4小题,共60分)
26.(14分)X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水。
(1)Y的元素符号是_______________XW的电子式是________________
(2)XW与YX3反应生成一种盐,该盐水溶液的pH______________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)___________________________
(3)Z元素氢化物的沸点比H2O_________(填“低”或“高”)。Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式________ _____________
(4)用石墨电极电解W的钠盐饱和溶液,反应的离子方程式为___ ___ ,
若反应的溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为 。
27.(14分)某些物质的转化关系如下图所示。其中甲可由两种单质直接化合得到;乙为金属单质,常温下,它在G的浓溶液中不溶解;F的溶液中只含一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。
 |
(1)若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。
① 写出B和甲反应的化学方程式 。
② 1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式 。
③D与乙反应的离子方程式是 。(2)若B为红棕色固体,C能使品红试液褪色,D的水溶液中加人HNO3酸化的AgNO3溶液有白色沉淀生成,向F中加入过量的NaOH溶液,有沉淀产生。
① 工业上反应II在 中进行。
② D和乙反应的化学方程式是 。
③ B、D、F中含同一种元素,该元素在周期表中的位置是: 。④写出由B为原料,得到该元素单质的化学方程式: _______。
28.(16分)某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置已略去)
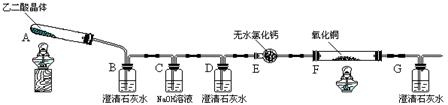
(1)装置C中盛放NaOH溶液的作用是 。
(2)①证明分解产物中有CO2的现象是 。
②证明分解产物中有CO的现象是
(3)实验结束后,装置F中黑色氧化铜变为红色固体。简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):
(4)该装置有一个不足之处,请写出弥补这个不足之处的理由和具体方法:
。
(5)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化。KMnO4和草酸钠在稀硫酸中反应的离子方程式是
②实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取0.2000 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,用配置好的KMnO4溶液滴定。当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30 s不褪色,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00 mL | 16.02 mL | 16.00mL | 16.01 mL |
KMnO4溶液的物质的量浓度的计算式是
c(KMnO4)= 。
![]() 29.(16分)下面表示的是某有机物烃A在一定条件下转化为H与N的关系,其中N是高分子。已知:
29.(16分)下面表示的是某有机物烃A在一定条件下转化为H与N的关系,其中N是高分子。已知:

![]() 回答下列问题:
回答下列问题:
(1)写出G具有的官能团名称
写出反应类型:② ,③ 。
(2)写出有机物的结构简式:F ,B 。
(3)写出下列化学方程式:
D→E: 。
R→N: 。
(4)F也可以经一步反应生成R,其反应条件是: 。
(5) E的同分异构体有多种,其中属于苯的二取代物,且既能起银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有6种,请写出其中任意一种的结构简式 。
理科综合试题化学学科答题卷
| 题序 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
|
|
|
|
|
|
|
|
26.(14分)
(1)_______________,________________
(2)pH_________7, _________________________ __
(3)_________(填“低”或“高”), _________________________
(4)___________ ___,
27.(14分)
(1) ①
②
③
(2) ① ②
③ ④ _____ _
28、(16分)
(1) 。
(2)① 。②
(3)
(4) 。
(5)①
计算式c(KMnO4)= 。
29.(16分)
(1) ,
(2) F ,B
(3) D→E:
R→N:
(4) ,(5) 。
理科综合试题化学学科参考答案
命题人:胡冬雪 审核人:项延辉
| 题序 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | A | D | C | C | C | B | D |
![]() 26、(14分)
26、(14分)
(1)N
(1分) (2分)(2)小于(1分) NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
![]() (3)低于 Cu2++H2S=CuS↓+2H+
(3)低于 Cu2++H2S=CuS↓+2H+
(4) 2Cl- + 2H2O Cl2↑+H2↑+2OH-,0.71g
27、(14分)
|
② 4NH3(g)十5O2(g)=4NO(g)+6H2O(g);△H= -906.8 kJ·mol-1 (3分)
③ 2Al+2OH一十2H2O=2AlO2-+3H2↑ (2分)
|
28、(16分)(以下每空2分)
(1)吸收乙二酸晶体受热分解生成的二氧化碳 (2)①装置B中澄清石灰水变浑浊
②装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊(不写全不给分)
(3)取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色。(操作给1分,观察现象给1分)
(4)在G装置后加燃着的酒精灯处理尾气CO,以防止其污染空气。
(5)(每空3分)① 2MnO4-+ 16H+ +5C2O42- ==== 2Mn2+ + 10CO2↑ + 8H2O
②![]() (不写单位不给分)
(不写单位不给分)
29、(16分)
(1) 羟基、羧基(各1分)② 取代反应 ,③ 消去反应。(各1分)

![]() (4)
NaOH乙醇溶液、加热。(2分)
(5)
(4)
NaOH乙醇溶液、加热。(2分)
(5) 等 (2分)
等 (2分)