高考理综化学模拟试题(一)
可能用到的相对原子质量:H-1 C-12 O-16 Cu-64 Cl-35.5
一、选择题(本题包括8小题。每小题给出的四个选项中,只有一个选项正确,选对的得6分,共48分)
6.食品卫生与人类的身体健康密切相关,下列做法对人体无害的是 ( )
A.使用“瘦肉精”饲料(一种含激素的饲料)养猪,增大猪的瘦肉产量
B.用福尔马林(50%的甲醛)使鱼肉等食品长时间保鲜
C.在鸭饲料里添加工业染料“苏丹红”使鸭子生产红心鸭蛋
D.在食盐中加乳酸锌以防止儿童缺锌
7、2008年北京奥运会拟用臭氧、活性炭对游泳池进行消毒和净化,下列说法不正确的是
A、臭氧能杀死水中的病菌,而不影响水质。
B、漂粉精长期露置在空气中会失效。
C、广谱高效杀菌剂二氧化氯的消毒(生成氯离子)效果是等质量的氯气的2.5倍。
D、活性炭能吸附水中的悬浮杂质,对水进行净化
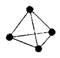 8、最近罗马大学Fulvio
Cacace等人获得了极具理论研究意义的N4分子,N4分子结构如右图所示(与白磷P4相似)。已知断裂1mol N—N吸收167kJ热量,生成1mol
8、最近罗马大学Fulvio
Cacace等人获得了极具理论研究意义的N4分子,N4分子结构如右图所示(与白磷P4相似)。已知断裂1mol N—N吸收167kJ热量,生成1mol ![]() 放出942kJ热量。由此判断下列说法正确的是
放出942kJ热量。由此判断下列说法正确的是
A.N4属于一种新型的化合物 B.N4与N2互为同分异构体
C.N4沸点比P4(白磷)高 D.1molN4气体转变为N2将放出882kJ热量
9.下列反应的离子方程式正确的是 ( )
A.少量的盐酸逐滴滴入碳酸钠溶液:CO32- +2H+==== CO2↑+H2O
B.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
C.少量SO2通入漂白粉溶液中:Ca2++2ClO-+H2O+SO2=CaSO4↓+2HclO
|
D.用惰性电极电解MgCl2溶液:2H2O+2Cl- Cl2↑+H2↑+2OH-
10.用高铁酸钠(Na2FeO4)对江河湖水消毒水消毒是城市饮
水处理的新技术。已知反应Fe2O3+3Na2O2 2Na2FeO4+Na2O有关该反应的叙述正确
的是 ( )
| |
B.Na2FeO4是一种氧化性比Na2O2更强的氧化剂
C.3molNa2O2发生反应时,有12mol电子发生转移
D.在Na2FeO4中Fe为+6价,其还原产物为Fe3+,Fe3+水解生成氢氧化铁胶体还有净水作用
11.下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③NH4HSO4三种溶液中
c(NH4+):③<②<①
D.相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
12、在恒温恒容的密闭容器中放入一定量的NO2,发生反应2NO2(g)![]() N2O4(g);ΔH<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是( )
N2O4(g);ΔH<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是( )
A.降低温度 B.通入NO2 C通入N2O4 D.升高温度
13.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时发生的反应:
Fe+NiO2+2 H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
下列有关对爱迪生蓄电池的推断错误的是( )
A.放电时,Fe是负极,NiO2是正极
B.充电时,阴极上的电极反应式为Fe(OH)2+2e-====Fe+2OH-
C.放电时电解质溶液中的阴离子是向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
26. (13分)甲、乙、丙均为中学化学常见的气体单质,A、B、C 均为常见的化合物。可供参考的信息有: ① A和B都极易溶于水,用两根玻璃棒分别蘸取A和B 的浓溶液后相互靠近,会看到白烟。
② 甲与乙在一定条件下反应的有关数据为:
| 物质 | 甲 | 乙 | A |
| 起始时浓度 | 3 mol/L | 3 mol/L | 0 |
| 2 s 末浓度 | 1.8 mol/L | 2.6 mol/L | 0.8 mol/L |
 ③ 它们之间存在如下图所示的转化关系:
③ 它们之间存在如下图所示的转化关系:
根据上述信息,回答下列问题:
(1)用A、B、C所代表的物质的电子式填空:
固态时属于离子晶体的是 。
(2)甲与乙反应生成A(在2 s 内)的平均速率![]() (甲)= ;2 s末乙的转化率为
;甲与乙反应生成A 在工业生产中的条件是
。
(甲)= ;2 s末乙的转化率为
;甲与乙反应生成A 在工业生产中的条件是
。
A对人的眼、鼻、喉等粘膜有刺激作用,如果不慎接触过多出现病状,要及时采取_________________________________________________________等措施。
(3)写出C与NaOH溶液在加热条件下反应生成A的离子方程式:
。
(4)写出C溶液与镁粉反应生成混合气体的化学方程式:
。
27.(13分)A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
|
(1)H的化学式为 ,D的电子式为 。
(2)A→N反应的离子方程式为 。
(3)D与G反应的化学方程式为 。
(4)I可用于净化水,其原因是
(用相关的反应方程式和简要文字回答)。
(5)通常状况下,1摩尔气体E在气体F中完全燃烧生成液态G时放出的热量为a kJ,请写出表示E燃烧热的热化学方程式 。
(6)I与NaOH溶液反应生成的沉淀再与NaOH和NaClO的混合液作用,是制备理想的绿色水处理剂(Na2MO4)的一种方法,
试写出此反应的化学方程式 。
28、(15分)0.2mol有机物A在氧气中完全燃烧后,生成79.2gCO2和18g水,同时消耗O247.04L(标准状况),A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):

其中K与FeCl3溶液能发生显色反应,且环上的一元取代物只有两种结构。已知:
①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH—→RCH2CHO。
② —ONa连在烃基上不被氧化。
请回答下列问题:
(1)写出结构简式:B:____________J:______________
(2)上述变化过程中,属于取代反应的是(填编号① ② ③……)______________
(3)写出下列反应的化学方程式(有机物用结构简式表示)。
①G—→F+C: ________________________________________________
②D—→I:_____________________________________________________
③K与过量的Na2CO3溶液反应:__________________________________________
(4)同时符合下列要求的A的同分异构体有__________种。
①含有苯环 ②能发生银镜反应和水解反应
③在稀NaOH溶液中,1mol该同分异构体能与1molNaOH反应
29.(19分)已知乙二酸(HOOC—COOH)俗称草酸,易溶于水,为二元弱酸,酸性强于碳酸,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。
根据上述信息,回答下列问题。
(1)向盛有2mL饱和NaHCO3溶液的试管里加入约2mL乙二酸浓溶液,观察到有无色气泡产生,写出该反应的离子方程式: 。
(2)测定某未知浓度的KMnO4溶液(滴定时KMnO4溶液置于锥形瓶中),可用草酸作还原剂,估计需用0.50mol/L的草酸溶液90mL。则用草酸晶体(H2C2O4·2H2O)配制溶液时,所用的定量玻璃仪器是 (注明仪器规格);如果在定容时仰视,则所测得KMnO4溶液的浓度将 _____________(填“偏大”、“偏小”或“不变”)。滴定时的反应原理可表示为:
| |
| |
| |
| |
| |
| |
配平上述反应的离子方程式(化学计量数填入上面相应的方框内);
则滴定终点时的颜色变化为: 。
(3)向试管A中加入 3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸,按下图I连接好装置,加热3—5min。在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生。试管B中加入饱和Na2CO3溶液的目的是 。
B中导管口在液面上而不伸入液面下的原因是 。
|
![]() (4)已知草酸分解的化学方程式为:H2C2O4 H2O+CO2↑+CO↑。
(4)已知草酸分解的化学方程式为:H2C2O4 H2O+CO2↑+CO↑。
右图是教材上的一个实验装置图,进行该实验的目的是:验证乙二酸分解是否有二氧化碳生成。某同学指出该实验装置的试管口略向下倾不合理,其理由是:
 。
。
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解。连续加热一段时间后的现象是:图Ⅱ①;试管里澄清石灰水变浑浊后,又变澄清,其原因 是 ;图Ⅱ②:试管里澄清石灰水变浑浊,其原因是 ;能验证草酸受热分解的装置图是 (填图形编号),该装置的特点是 。
参考答案及评分标准
一、选择题(本题包括8小题,只有一个选项正确,选对的得6分,共48分)
6、D 7、C 8、D 9、B 10、D 11、A 12、D 13、C
26.(13分)(1) ![]() (2分)
(2分)
(2)0.6 mol·L-1·s-1 (1 分) 13.3% (2 分)
催化剂、500℃ 左右、20 MPa ~ 50 MPa (2 分,错一个扣1 分,答n(N2):n(H2)= 1 :3 ,不给分也不扣分)。
吸入新鲜空气和水蒸气,并用大量水冲洗眼睛(2分)
(3)NH4+ + OH- ![]() NH3↑+ H2O (2 分)
NH3↑+ H2O (2 分)
(4)2 NH4Cl + Mg === MgCl2 + 2 NH3↑+ H2↑ (2 分)
27.(13分)(1)Fe3O4 (1分) ![]() (1分)
(1分)
|
(2)2Cl-+2H2O Cl2↑+H2↑+2OH- (2分)
(3)2Na2O2+2H2O=4NaOH+O2↑ (2分)
![]() (4)Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3(胶体)具有较大的表面积,能吸附水中悬浮物质,使水净化。
(2分)
(4)Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3(胶体)具有较大的表面积,能吸附水中悬浮物质,使水净化。
(2分)
(5)H2(g) + 1/2O2 (g)== H2O(l);△H=-akJ/mol (3分)
(6)2Fe(OH)3 +3NaClO + 4NaOH = 2Na2FeO4+3NaCl+5H2O (2分)
28.(15分)
(1) (每空各2分,共4分)
(每空各2分,共4分)
(2)①⑦(2分)
(3)①CH3COOCH=CH2+NaOH→CH3COONa+CH3CHO(2分)
②![]() (2分)
(2分)
③![]() (2分)
(2分)
(4) 5 (3分)
29.(19分)(1)2HCO3—+(COOH)2 2H2O+2CO2↑+(COO)22—
(或HCO3—+(COOH)2 H2O+CO2↑+HOOC—COO—,也给分)
(2分)
(2)100mL容量瓶 (1分) 偏大 (1分)
2 5 6—2 10 8(2分) 由红色变无色 (1分)
(3)吸收乙醇,降低酯的溶解(2分) 防止倒吸(或防止B中液体倒吸至A中)(1分)
(4)因为乙二酸晶体在分解前就已熔化成液态 (2分)
草酸受热分解产生CO2,CO2使澄清石灰水变浑浊,过量CO2使浑浊又变澄清(2分)
由于草酸蒸气逸出,与石灰水反应生成草酸钙沉淀 (2分)
图Ⅱ① (1分) 冷凝回流,避免草酸蒸气逸出(2分)

