08届高考化学复习模拟题四
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 分数 |
说明:本套试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分.考试时间:90分钟.
可能用到的相对原子质量:C:12 H:1 O:16
第Ⅰ卷(选择题,共64分)
一、选择题(本题包括16小题,每小题4分,共64分.每小题只有一个选项符合题意.)
1.下列有关化学史实的叙述中不正确的是( )
A.原子分子学说的建立,是近代化学发展的里程碑
B.揭示物质世界的一项根本性的规律是元素周期律
C.侯德榜因发明联合制碱法而荣获诺贝尔化学奖
D.1965年我国科学家在世界上第一次用人工方法合成了结晶牛胰岛素
2.下列有关比较中正确的是( )
A.元素的种类多于原子的种类 B.元素的种类与单质的种类相等
C.氢键弱于分子间作用力 D.分子晶体的熔沸点低于离子晶体的熔沸点
3.生活中的问题常涉及化学知识,下列过程不涉及化学变化的是( )
A.用食醋或醋精除去暖瓶内的水垢 B.用四氯化碳擦去圆珠笔油渍
C.用糯米饭、酒曲等自制甜酒酿 D.用75%的乙醇溶液进行皮肤消毒
4.人们把食品分为绿色食品、蓝色食品、白色食品等.绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵制得的食品叫白色食品.下面属于白色食品的是( )
A.酱油 B.面粉 C.海带 D.菜油
5.2002年诺贝尔化学奖授予将“化学生物学提升为现代最大科学”的三位化学家,利用三人的研究成果,可以迅速地辨识蛋白质,制造出溶液中蛋白质分子的三维空间影像.下列关于蛋白质的说法不正确的是( )
A.重金属盐能使蛋白质变性,所以误食重金属盐时,可以喝牛奶等解毒
B.白明胶、阿胶的主要成分是蛋白质
C.蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解
D.浓硝酸溅到皮肤上,使皮肤呈现黄色是由于浓硝酸与皮肤发生了颜色反应
6.据最新报道钬的放射性同位素![]() 可有效地治疗肝癌.该同位素原子核内的中子数与核外电子数之差是( )
可有效地治疗肝癌.该同位素原子核内的中子数与核外电子数之差是( )
A.32 B.67 C.99 D.166
7.市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性 ②使用时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣物,其有效成分可能是( )
A.![]() B.
B.![]() C.NaClO
D.
C.NaClO
D.![]()
8.“喷水溶液法”是最近日本科学家研制出的一种使沙漠变绿洲的新技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,即能阻止地下的盐分上升,又有拦截、蓄积雨水的作用.下列对聚丙烯酸酯的说法不正确的是( )
A.单体的结构式为![]() =CH—COOR B.在一定条件下能发生加成反应
=CH—COOR B.在一定条件下能发生加成反应
C.在一定条件下能发生水解反应 D.没有固定的溶沸点
9.大气层外的臭氧层的作用是( )
A.吸收![]() B.分解补充
B.分解补充![]() C.吸收红外线
D.吸收紫外线
C.吸收红外线
D.吸收紫外线
10.在做下列气体的实验时,可以不在通风橱或密闭系统中进行的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
11.具有相同质子数的两种微粒( )
A.一定是同种元素 B.一定是一种分子和一种离子 C.一定是不同的离子 D.无法判断
12.明矾净水的作用是( )
A.使暂时硬水软化 B.使永久硬水软化 C.除去水中悬浮物 D.消毒杀菌
13.在溶液导电性实验装置里,分别注入20mL4mol·![]() 的醋酸和20mL4mol·
的醋酸和20mL4mol·![]() 的氨水,灯光明暗程度相似,如果把这两种溶液混合后再试验,则( )
的氨水,灯光明暗程度相似,如果把这两种溶液混合后再试验,则( )
A.灯光明暗程度不变 B.灯光变暗 C.灯光变亮 D.灯光明暗程度变化不明显
14.不同浓度的![]() 分别与一定量的锌粉完全反应,还原产物分别为
分别与一定量的锌粉完全反应,还原产物分别为![]() 、NO和
、NO和![]() ,若反应的锌物质的量相等时,参加反应的硝酸物质的量之比是( )
,若反应的锌物质的量相等时,参加反应的硝酸物质的量之比是( )
A.2∶4∶5 B.1∶2∶5 C.1∶2∶2 D.24∶16∶15
15.为解决污染和能源上的重大问题,有些化学家提出一些化学反应的步骤,如:
①![]() ②
②![]()
③![]() ④
④![]()
但这些设想如何进一步操作尚未解决.这种联合反应的目的是为了制备( )
A.HBr
B.![]() C.
C.![]() D.Hg
D.Hg
16.还原2.4×![]() 到X元素的低价态时,需消耗30mL0.2mol·
到X元素的低价态时,需消耗30mL0.2mol·![]() 的亚硫酸钠溶液,则在此反应中X元素的低价态为( )
的亚硫酸钠溶液,则在此反应中X元素的低价态为( )
A.0价 B.+1价 C.-1价 D.-2价
第Ⅱ卷(非选择题,共56分)
二、(本题包括两小题,共20分)
17.(8分)下列有关实验的叙述,正确的是(填序号)________
A.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤 B.用渗析法分离淀粉中混有的NaCl杂质
C.用分液漏斗将甘油和水的混合液体分离 D.用碱式滴定管量取20.00mL高锰酸钾溶液
E.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F.用浓氨水洗涤做过银镜反应的试管
G.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
18.(12分)某种碱式碳酸铜,其组成可表示为:![]() .在加热条件下,可以发生分解,化学方程式为:
.在加热条件下,可以发生分解,化学方程式为:![]()
现取一定量(不称量其质量)该固体样品,先后完成两个实验:
实验(i):测定该碱式碳酸铜粉末组成中结晶水x的值;
实验(ii);用实验(i)结束后的残留固体完成乙醇的催化氧化并验证其反应产物.
请回答下列问题:
(1)用下图中的仪器(必要的铁架台、铁夹、酒精灯等均在图中略去,橡皮塞可以在有孔、无孔之间替换)组装完成实验(i)的实验装置,组装时仪器按气流方向从左到右连接的顺序为________→________→________→________.在这套装置中,干燥管的作用是_______________________________________________.

(2)若要用上图中的仪器组装完成实验(ii)的实验装置,组装时仪器也按气流方向从左到右连接的顺序为________→________→________→________.在这套装置中,干燥管的作用是_________________________________________________________________.
(3)在完成两个实验时,首先都必须先________,然后在仪器________(填装置对应字母)中加入碱式碳酸铜,乙醇放入仪器________(填装置对应字母)中.
(4)这两套装置中,在实验时需要加热的是_______________(填装置对应字母).
(5)证明乙醇的催化氧化产物是乙醛的反应的化学方程式为_________________________________________
(6)这两套装置中,在实验前后均需要连同所盛试剂一起准确称量的仪器是________(填装置对应字母).
三、(本题包括两小题,共20分)
19.(10分)(1)小苏打是治疗胃酸过多的一种药剂,但对于胃溃疡严重的病人不能使用,你认为可能的原因是________________________________________________________________________.
(2)有一种常见的用来治疗胃溃疡的药物,服用后也能中和胃酸且作用持久,该化合物是带一定量结晶水的三硅酸镁,加热使之完全失水后,1mol该物质中仍含有8mol氧原子.
①加热后的产物的化学式是________________________________,改写成氧化物的形式为______________;
②写出该化合物中和胃酸的化学方程式:(假设化合物分子中带有n个结晶水)
_____________________________________________________________________________________.
20.(10分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……今有HA、![]() 、
、![]() 三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐
三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐![]() 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①![]() ②
②![]() ③
③![]()
回答下列问题:
(1)相同条件下,HA、![]() 、
、![]() 三种酸中酸性最强的是_______________________.
三种酸中酸性最强的是_______________________.
(2)![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() -6种离子中,最易结合质子的是____________________________,最难结合质子的是____________________________.
-6种离子中,最易结合质子的是____________________________,最难结合质子的是____________________________.
(3)判断下列反应的离子方程式中正确的是(填写标号)__________________________.
A.![]() B.
B.![]() C.
C.![]()
(4)完成下列反应的离子方程式.
A.![]() (过量)__________________________________________________________________;
(过量)__________________________________________________________________;
B.HA(过量)![]() __________________________________________________________________.
__________________________________________________________________.
四、(本题包括两小题,共16分)
21.(8分)已知反应:![]() ,下图是表示有机物A、B
,下图是表示有机物A、B
等发生一系列反应的变化关系:

其中:A是密度为1.25g/L(标准状况)的烃,B、x的分子式都符合![]() ,其中x,y互为同分异构体,F与C是同系物,D与E也是同系物,B是直链化合物.
,其中x,y互为同分异构体,F与C是同系物,D与E也是同系物,B是直链化合物.
(1)A的摩尔质量为________,B的结构简式为______________________________.
(2)变化E+F→y所属的有机反应类型是____________________________________.
(3)写出实现下列变化的化学方程式(有机物写结构简式,注明反应条件).
①A→C___________________________________________________________________________________.
②C+D→x________________________________________________________________________________.
22.(8分)氨基钠(![]() )是碱性很强的离子化合物,在液氨中,氯苯与氨基钠作用生成苯胺(
)是碱性很强的离子化合物,在液氨中,氯苯与氨基钠作用生成苯胺(![]() ),反应经历了中间体苯炔(
),反应经历了中间体苯炔(![]() )这一步
)这一步
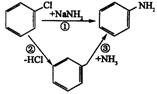
(1)如果将反应按加成、取代、消去分类,则反应①属________反应,反应②属________反应,反应③属________反应.
(2)如果用![]() 标识与氯原子相连的碳原子(其余的碳原子均为
标识与氯原子相连的碳原子(其余的碳原子均为![]() ),那么,这种氯苯与氨基钠在液氨中反应,支持反应必定经历中间体苯炔这一步的事实是(从下列选出)____________________________.
),那么,这种氯苯与氨基钠在液氨中反应,支持反应必定经历中间体苯炔这一步的事实是(从下列选出)____________________________.
A.产物苯胺只有一种,氨基全部连在![]() 上
上
B.产物苯胺有两种,氨基连在![]() 上比连在相邻的
上比连在相邻的![]() 上的多
上的多
C.产物苯胺有两种,氨基连在![]() 上和连在相邻的
上和连在相邻的![]() 的一样多
的一样多
(3)苯胺可以由硝基苯与铁、稀盐酸反应得到,写出反应的化学方程式:_______________________________.
参考答案
一、
1.C
2.D 元素的种类少于原子的种类.元素的种类少于单质的种类.氢键强于分子间作用力.
3.B 用四氯化碳擦去圆珠笔油渍,溶解属于物理变化.
4.A 5.C 盐析是可逆的.
6.A 7.C NaClO水溶液由于水解而显碱性.
8.B 聚丙烯酸酯的结构简式为:![]() ,无不饱和键存在,不能发生加成反应.
,无不饱和键存在,不能发生加成反应.
9.D
10.D 无毒气体可以不在通风橱和密封系统中进行实验.
11.D 具有相同质子数的两种微粒间可能是同种元素的不同原子,也可能是一种分子和一种离子,或两种不同的分子或两种不同的离子.
12.C 胶体吸附悬乳物.
13.C 两弱电解质反应后变成强电解质.
14.D 化学方程式计算法,先写出三个不同反应的化学方程式,并取Zn系数的最小公倍数作为等量的锌(12mol)
![]()
12mol 12×4mol
![]()
12mol 12×![]() mol
mol
![]()
12mol 12×![]() mol
mol
参加反应硝酸物质的量之比:![]()
15.B 此联合反应是一种理论上的设想,根据以![]() 、
、![]() 和Hg为基本原料,进行如上的几步反应,消耗水以制取氢气,反应过程中
和Hg为基本原料,进行如上的几步反应,消耗水以制取氢气,反应过程中![]() 和Hg可以循环使用.
和Hg可以循环使用.
16.B ![]() 中X为+6价.2.4×
中X为+6价.2.4×![]() mol
mol ![]() 能被30mL 0.2mol·
能被30mL 0.2mol·![]()
![]() 还原,即1mol
还原,即1mol ![]() 可获得
可获得![]() 电子
电子
∴ X元素在此反应中低价为+1价.
二、
17.B、G
18.(1)F、E、B、C,吸收空气中的水蒸气
(2)A、F、C、D,检验反应中生成的水
(3)检查装置的气密性,F,A (4)A、D、F
(5)![]()
(6)B、E
三、
19.(1)小苏打与胃酸反应会放出二氧化碳,可能会使胃壁较薄的胃溃疡病人“胃穿孔”
(2)①![]() ,
,![]()
②![]()
20.(1)![]() (2)
(2) ![]() ,
,![]() (3)BC
(3)BC
(4)![]()
![]()
四、
21.(1)28g/mol;![]()
(2)酯化反应(或取代反应)
(3)①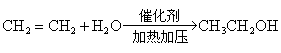
②![]()
![]()
![]()
22.(1)①取代,②消去,③加成(2)C
(3)![]()