高考化学预测卷
第一卷
一、选择题
1.2008年北京奥运会主体育场的外形好似“鸟巢” (The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是
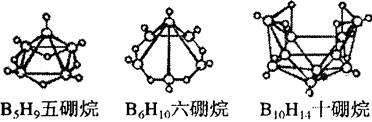
A.这类巢式硼烷的通式是BnHn+4
B.1molB5H9完全燃烧转移25mol电子
C.8个硼原子的巢式硼烷化学式应为B8H10。
D.硼烷与水反应是非氧化还原反应
2.Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化
学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法中不正确的是
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2mol FeSO4发生反应时,共有10mol电子转移
3.在下列数量含有10电子的物质中:
①质量为34.0g的氨气;
②标准状况下体积为11.2L的氟化氢;
③4℃时体积为22.4mL的纯水;
④标准状况下体积为22.4L的甲烷。所含质子数由多至少的正确排列是
A.②>①>③>④ B.①>③>④>②
C.④>②>①>③ D.①>④>③>②
4.有机物甲可氧化生成羧酸,也可还原生成醇。由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是
A.甲分子中碳的质量分数为 40%
B.乙比甲的沸点高
C.乙和甲的最简式不相同
D.甲氧化生成的羧酸分子结构中含有醛基
5.短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C
B.沸点:A的氢化物低于C的氢化物
C.B的硫酸盐溶液pH<7
D.5.6g铁与足量的C化合,转移0.3mol电子
6.在pH=a的某电解质溶液中,插入两支惰性电极,通直流电电解一段时间后,溶液的PH=b,若a>b,则该电解质可能是
A.CuSO4 B.Na2SO4
C.NaOH D.HCl
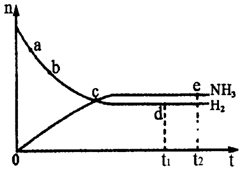
7.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
|
在673K、30Mpa下n(NH3)和n(H2)
随时间变化的关系如图所示。下列叙述
正确的是
A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)
不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)
比图中d点的值小
8.常温下,将V1 mL、c1 mol·L-1的氨水滴加到V2 mL、c2 mol·L-1的盐酸中,下列结论正确的是
A.若混合溶液的pH=7,则c1·V1>c2·V2
B.若V1=V2,c1=c2,则混合液中c(NH+4)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH+4)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
第二卷
二、主观题
9.A、B两种物质都是由H、N、O、Na四种元素中任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性。请找出A和B可能的两种组合。要求:
①浓度相同时,第一种组合A溶液的pH大于第二种组合中A溶液的pH;
②当这两种组合中的B溶液的pH相等时,第一种组合的B溶液中水的电离程度小于第二种组合的B溶液中水的电离程度。
写出可能有的组合中A与B的化学式。
第一种组合:A ________________;B__________________;
第二种组合:A_________________;B__________________。
10、由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1mol B离子与1mol E离子作用可生成2mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1)微粒A的电子式是_____________;微粒E的名称是_____________。构成微粒F的元素在元素周期表中的位置是__________________。
(2)写出下列反应的离子方程式:
F+过量C溶液:____________________________________________________
W+含大量B离子的溶液:____________________________________________
(3)六种微粒中的两种可与硫酸根形成盐,向这两种盐混合后的浓溶液中逐滴加入浓苛性钠溶液,产生的现象有:
a.溶液中出现白色沉淀
b.有刺激性气味气体放出
c.沉淀逐渐增多
d.沉淀完全消失
e.沉淀逐渐减少
上述各实验现象由先到后出现的正确顺序是(填写序号)___________________。
|
|
|
Br—CH2—CH2—O—C—CH2—CH—C—O—…………
已知:X在足量的氢氧化钠水溶液中加热,可得到A、B、C三种有机物。
|
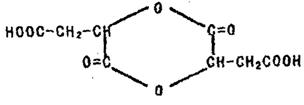
②室温下A经盐酸酸化可得到苹果酸E,E的结构简式为HOOC—CH2—CH—COOH
请回答:
(1)E中含有的官能团是 ;
(2)C经酸化可得到有机物G,G可以发生的反应类型有 (填序号)
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)B的结构简式为 ;
(4)E的一种同分异构体F有如下特点:1molF可以和3mol金属钠发生反应,放出33.6LH2(标况下),1molF可以和足量NaHCO3溶液反应,生成1molCO2,1molF还可以发生银镜反应,生成2molAg。则F的结构简式可能是(只写一种)
_________________________________
(5)在一定条件下两分子E可生成六元环酯,写出此反应的化学方程式
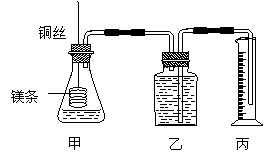 12.某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足
12.某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足
量镁带反应时,生成氢气的体积相同而反应速率
不同,同时测定实验室条件下的气体摩尔体积。
设计的简易实验装置如右图。该实验的主要操作
步骤如下:
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1
盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝
末端,a的数值至少为____________________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
____________。
⑵本实验中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
参考答案:
9.学生现状:由H、N、O、Na四种元素中任选三种元素学生不能全面迁移到具体的物质,更不能从中筛选出强电解质;对两种浓度相同的强电解质A溶液,为什么pH会有差异,以及对pH相等的两种强电解质B溶液为什么会使水的电离程度产生差异等引起的原因缺乏必要的思维与敏锐的洞察能力。
解析:H、N、O、Na四种元素中任选三种元素组成的化合物有NaOH、HNO3、NaNO3、NaNO2、NH4NO3、NH3·H2O等,其中NaOH、HNO3、NaNO3、NaNO2、NH4NO3属于强电解质, A的水溶液呈碱性,则在NaOH和NaNO2中选,第一种组合A溶液的pH大于第二种组合中A溶液的pH,故第一种组合A是NaOH,第二种组合A是NaNO2;B的水溶液呈酸性,则在HNO3和NH4NO3中选,第一种组合的B溶液中水的电离程度小于第二种组合的B溶液中水的电离程度,故第一种组合的B是HNO3,抑制了水的电离,第二种组合的B是NH4NO3促进了水的电离。
10、(每空2分,共12分)
(1)![]() + 水合氢离子 第三周期、ⅢA族
+ 水合氢离子 第三周期、ⅢA族
(2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al(OH)3+OH-=AlO2-+2H2O
(3)a、c、b、e、d
11.(15分)
(1)羧基、羟基(或—COOH、—OH) ………………2分
(2)①③④ ………………3分
(3)HO—CH2—CH2—OH ………………3分
|
|
|
![]() (5)2HOOC—CH2—CH—COOH
2H2O+
(5)2HOOC—CH2—CH—COOH
2H2O+
|
………………4分
12、(16分)②酸式滴定管 (1分) ③0.12 (1分) ⑤反应起止时间 (1分)
⑥将量筒缓缓向下移动,使乙、丙中液面相平(2分)
⑴两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(只要表述明确、合理均可)(3分)
⑵B(2分)
⑶0.2V L·mol-1 (2分)
⑷酸的浓度相同时c(H+)不同 (2分) 防止形成原电池,干扰实验现象的观察(2分)