高考化学预测题
1.法国科学家最近发现一种只由四个中子构成的粒子,这种粒子被称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A. 该粒子不显电性 B. 该粒子质量数为4
C. 该粒子原子核外有4个电子 D. 该粒子质量比氢原子大
2.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是 ( )
A.0.05molC15H32分子中含有的共价键为2.3×6.02×1023
B.常温下,42g乙烯和丁烯的混合气体中含有的碳原子数为2×6.02×1023
 C.0.3molNO2与足量水反应转移电子数为0.3×6.02×1023
C.0.3molNO2与足量水反应转移电子数为0.3×6.02×1023
D.标准状况下,11.2L苯中所含原子总数为6×6.02×1023
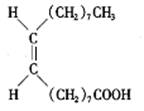
3.食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如右图所示。下列说法不正确的是 ( )
A.油酸的分子式为C18H34O2 B.油酸可与氢氧化钠溶液发生中和反应
| |
4.已知某溶液中存在H+、OH—、NH4+、Cl—,其离子浓度大小不可能是 ( )
A.c(Cl—)=c(NH4+)>c(H+)=c(OH—) B.c(Cl—)>c(H+)>c(NH4+)>c(OH—)
C.c(Cl—)>c(NH4+)>c(H+)>c(OH—) D.c(OH—)>c(H+)>c(Cl—)>c(NH4+)
5.下列离子方程式正确的是( )
A.NaHCO3溶液和NaOH溶液混合 HCO3-+OH-=CO2↑+H2O
B.将少量的二氧化硫气体通入次氯酸钠溶液中 SO2 + H2O +2ClO- = SO32- + 2HClO
C.氯化铝溶液中加入过量氨水:Al3+ + 4OH— = AlO2—+ 2H2O
D.苯酚钠溶液中通入少量CO2 C6H5O-+CO2+H2O → C6H5OH + HCO3-
6.Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分。铜的冶炼过程常发生反应:
Cu2S + 2Cu2O ===== 6Cu + SO2↑
关于此反应的说法正确的是 ( )
A,该反应有三种元素的化合价发生变化 B.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物 D.每生成0.1mol Cu,转移0.2 mol电子
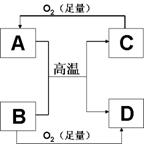 7.右图所示的反应均是在高温或引燃后进行。选项中的物质表示A和B,不合理的是( )
7.右图所示的反应均是在高温或引燃后进行。选项中的物质表示A和B,不合理的是( )
A.CO2、Mg B.MgO、Al
C.Fe3O4、Al D.CuO、H2
8.以下对化学实验的描述合理的是 ( )
A.实验室使用浓硝酸和浓盐酸以3:1的体积比混合配置王水。
B.中和滴定实验前,所使用的滴定管和锥形瓶必须洗净、干燥。
C.用于检验气体的试纸必须先湿润。
D.硫酸铜晶体里结晶水含量的测定实验中,盛晶体的坩埚灼烧后,需放在石棉网上冷却后称量
9.(14分)A、B、C是三种常见不同主族的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个。甲、乙、丙是三种元素最高价含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,戊为淡黄色粉末。甲、乙、丙、丁、戊、已六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
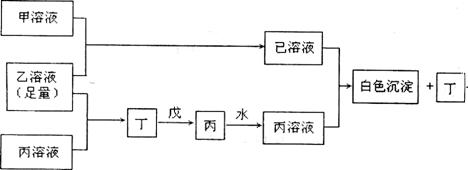
回答下列问题:
(1)写出A、B、C三种元素的元素符号 、 、 。
(2)写出戊的电子式 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是已和丁,写出不足量的乙溶液分别和甲溶液、丙溶液反应时的离子反应方程式:
乙+甲 ;乙+丙 。
(4)写出已溶液和丙溶液反应的离子方程式: 。
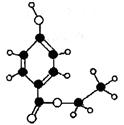 10.(16分)尼泊金酯是国际上公认的广谱性高效食品防腐剂,下图是一种尼泊金酯的球棍模型。回答问题:
10.(16分)尼泊金酯是国际上公认的广谱性高效食品防腐剂,下图是一种尼泊金酯的球棍模型。回答问题:
(1)请写出该物质的结构简式 ;
(2)该物质在一定条件下,能发生下图转化
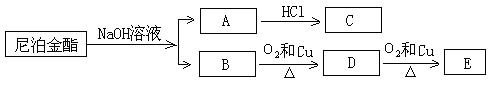
①1mol该尼泊金酯最多可以消耗 mol NaOH。
②向A中通入CO2,生成有机物的结构简式: 。
③B生成D的化学反应方程式:
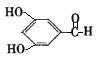
(3)写出符合下列要求的C的同分异构体(至少写两种): ,
①能与新制的Cu(OH)2悬浊液反应(加热),产生红色沉淀;
②苯环上的一氯代物有两种。
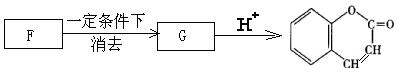
(4)该尼泊金酯的一种同分异构体可以被银氨溶液氧化生成F,F在一定条件下能发生下列转化而生成香豆素,F→G的化学方程式:
11.(16分)t℃ 时,将2mol N2和1mol H2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:
N2 ( g
) +3H2 ( g ) ![]() 2NH3
(g );ΔH <0
2NH3
(g );ΔH <0
2min后反应达到平衡,此时测得NH3的物质的量为0.2 mo1。请填写下列空白:
(1)从反应开始至达到化学平衡,生成NH3的平均反应速率为__ __;平衡时N2转化率为__ ___。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________
A.容器内压强不再发生变化 B.H2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗n molN2的同时消耗3n mol H2
E.相同时间内消耗n molN2的同时消耗2n mol NH3 F.容器内气体的密度不再发生变化
(3)反应达到化学平衡后,改变某个条件,引起平衡向正反应方向移动下列物理量数值一定增大的是_ _
A.N2的浓度 B.气体的平均分子量 C.生成NH3的物质的量 D.H2的转化率
(4)维持上述条件不变,加入a mol N2、b mol H2、cmol NH3,反应向逆方向进行,平衡时NH3的物质的量仍然为0.2 mo1,则c的取值范围是 。
(5)保持温度不变,使体积缩小为原来的一半,则N2的体积分数 (填“增大”、“减小”或“不变”)。请通过计算证明你的结论。
12.(14分)某课外活动小组设计了如图所示的装置。用于进行缓慢电解NaCl溶液及相关实验(此时打开止水夹a,关闭止水夹b)。由于某些原因,实验开始并没有达到预期的目的,但也看到了令人高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮他们分析原因,然后回答问题:
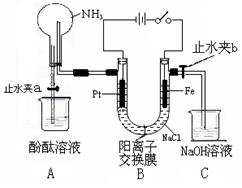 (1)写出B装置
(1)写出B装置![]() 中的电极反应:
中的电极反应:
阴极:
阳极:
(2)一段时间内依次观察到A中的现象为:
①
②
③
(3)当观察完A中的现象后,打开止水夹b。再观察C装置,若无现象说明理由,若有现象请写出有关反应的化学方程式
(4)若想达到电解NaCl溶液的目的,请对该装置进行最简单的改进
答案
1.C 2.A 3.C 4.D 5.D 6.B 7.B 8.C
9.(1)C、Al、S(3分) (2)![]() (2分)
(2分)
![]()
10.(1)![]() (2分)
(2分)
(2)2
(2分) ![]() (2分)
(2分) ![]() (3分)
(3分)
(3)![]()
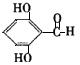 任选两个(共4分)
任选两个(共4分)
(4)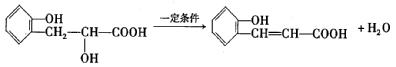 (3分)
(3分)
11.(1)0.05mol/(L·min)(2分) 5%(2分) (2)ABE(3分) (3) C(2分)
(4)0.2<C≤2/3 (3分) (5)增大(1分)
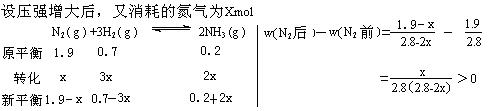 (3分)
(3分)
12.(每空2分)
(1)阴极:2H+ +2e—=H2 阳极:Fe—2 e—= Fe2+
(2)①烧杯中导管口有气泡冒出 ②烧杯中的水沿导管进入烧瓶,形成喷泉,烧瓶中溶液变红
③烧瓶中液体变少
(3)没有现象,因为铁做阳极,没有氯气生成。
(4)将铁换成石墨做电极
答案
1.C 2.A 3.C 4.D 5.D 6.B 7.B 8.C
9.(1)C、Al、S(3分) (2)![]() (2分)
(2分)
![]()
10.(1)![]() (2分)
(2分)
(2)2
(2分) ![]() (2分)
(2分) ![]() (3分)
(3分)
(3)![]()

 任选两个(共4分)
任选两个(共4分)
(4) (3分)
(3分)
11.(1)0.05mol/(L·min)(2分) 5%(2分) (2)ABE(3分) (3) C(2分)
(4)0.2<C≤2/3 (3分) (5)增大(1分)
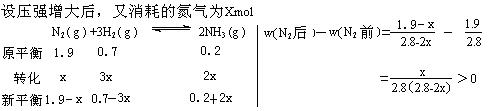 (3分)
(3分)
12.(每空2分)
(1)阴极:2H+ +2e—=H2 阳极:Fe—2 e—= Fe2+
(2)①烧杯中导管口有气泡冒出 ②烧杯中的水沿导管进入烧瓶,形成喷泉,烧瓶中溶液变红
③烧瓶中液体变少
(3)没有现象,因为铁做阳极,没有氯气生成。
(4)将铁换成石墨做电极