高考化学模拟试卷(一)
化 学
本试卷分第一卷(选择题)和第二卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第一卷(选择题 共64分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32
Cl-35.5 Cu-64 Ba-137
一.单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不吻合的是
A.用“绿色化学”工艺,使原料完全转化为产物
 B.推广燃煤脱硫技术,防治SO2污染
B.推广燃煤脱硫技术,防治SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥提高粮食产量
2.现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是
A.该物质的分子式为SN B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点 D.该物质与化合物S2N2互为同素异形体
3.汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确是
A.用盐的形式表示:BaSiO3·CuSiO3 B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱 D.性质稳定,不易褪色
4.下列叙述正确的是
A.称量NaOH固体常用小烧杯,目的是防止NaOH固体吸水潮解
B.用铁片和稀H2SO4反应制取H2时,为加快产生H2的速率可改用浓H2SO4
C.向混有乙酸的乙酸乙酯中加入饱和NaOH溶液,再分液以提纯乙酸乙酯
D.用银氨溶液检验蔗糖水解产物时,先加入适量NaOH是为了中和稀H2SO4
5.常温下,某溶液中由水自身电离产生的H+、OH-,其浓度满足c(H+)·c(OH-)=10-24。该溶液中一定能够大量存在的离子组是
A.Ba2+、Na+、Cl-、NO3- B.Al3+、Ca2+、SO42-、Br-
 C.NH4+、K+、HSO3-、CO32- D.Na+、K+、MnO4-、I-
C.NH4+、K+、HSO3-、CO32- D.Na+、K+、MnO4-、I-
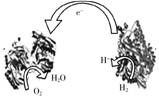
6.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的负极 B.该电池可在高温环境下使用
C.该电池负极反应为:H2—2e-=2H+ D.该电池正极反应为O2+4e-=2O2-
7.认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法正确的是
A.镁在空气中或纯净氧气中燃烧的产物一定只有MgO
B.钠在敞口容器中长期存放或在空气中燃烧的产物一定是Na2O2
C.一定条件下,SiO2与焦炭反应,生成的产物一定是单质硅
D.向苯酚钠溶液中通入少量CO2或过量CO2,产物一定含有NaHCO3
8.下列有关因果关系的描述正确的是
A.因为盐酸的酸性强于氢硫酸,所以氯元素的非金属性强于硫
B.因为醋酸电离吸热,所以用NaOH溶液中和等体积等浓度的醋酸和盐酸,前者放出热量少
C.因为KCl的溶解度随温度的降低而减小,所以降低温度KCl溶液的质量分数一定会减小
D.因为O2转化为O3是吸热反应,所以O3比O2稳定
二.不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.萜类物质中有许多都已被用于香料工业。常见的有如下几种结构(括号内表示④的结构简式):
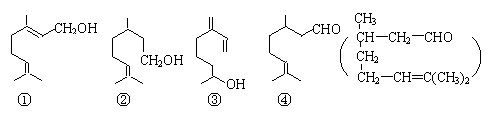 |
关于上述四种香料,下列说法正确的是
A.②和③均属于烯烃类 B.①和③互为同系物
C.④是②的氧化产物 D.③和④均能发生消去、酯化反应
10.已知A、B、C、D、E是核电荷依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B、E同主族,下列推断正确的是
A.A、B、E一定不在同一周期 B.D为第二周期元素
C.A、D不可能在同一主族 D.C、D的单质化合一定形成离子化合物
11.在实验室中从苯酚中分离出苯,可选用下列装置中的
|
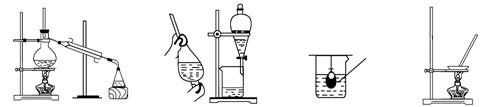
A. B. C. D.
12.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C![]() Pb+CO;PbO+CO
Pb+CO;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS冶炼成Pb理论上至少需要6g碳
13.NA表示阿伏加德罗常数,下列叙述中正确的是
A.9.6g铜与足量的稀硝酸反应,生成NO分子数一定为0.1NA
B.pH=1的甲酸溶液中,HCOO-和OH-数目之和为0.1NA
C.2.0gD2O中所含中子数为0.1NA
D.常温下,1.12L氮气所含原子数为0.1NA
14.下列反应的离子方程式书写正确的是
A.过氧化钠固体与水反应:2O22—+2H2O=4OH-+O2↑
B.氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O
Cl2↑+Mn2++2H2O
D.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O
15.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-) B.2c(NH4+)=c(SO42-)
C.c(NH4+)>c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
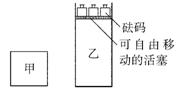 16.一定温度下,有可逆反应:2A(g)+2B(g)
16.一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同。下列说法正确的是
C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同。下列说法正确的是
A.甲、乙两容器中的反应达到化学平衡时,两容器内压强相等
B.甲、乙两容器中的反应达到化学平衡时,C的体积分数相等
C.向甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度不变
D.向乙容器中再充入2molC和6molD,平衡后乙中物质C的浓度为原来的2倍
第二卷(非选择题 共86分)
三.(本题包括2小题,共20分)
17.(8分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 | 有少量气泡产生,溶液的黄绿色褪去 |
| 步骤2 | 将第一份滤液与稀盐酸混合 | 产生大量气泡 |
| 步骤3 | 将第二份滤液加热 | 溶液变浑浊,且有大量无色气体产生 |
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是 ;为达到该实验目的,还可以采取的方法是 。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大: 。
18.(12分)纳米材料在绝大多数同学眼里都非常神秘。某化学学习小组决定通过查阅有关资料,自己动手实验,制备纳米铁粉。
【实验原理】
⑴用硫酸亚铁、草酸两溶液制备草酸亚铁晶体(溶解度较小)。该反应的化学方程式是
。
⑵焙烧草酸亚铁晶体:FeC2O4·2H2O![]() Fe+2CO2↑+2H2O↑
Fe+2CO2↑+2H2O↑
【操作步骤】
⑴草酸亚铁晶体的制备
 |
①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、FeSO4、草酸等实验用品,为配制上述两溶液,缺少的仪器有 。
②若配制的FeSO4溶液略呈黄色,可能的原因是 。
③检验草酸亚铁晶体是否洗净的方法是 。
 ⑵纳米铁粉的制备
⑵纳米铁粉的制备
将一根长度约为12 cm~14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①实验中分解产生CO2所起的作用是 。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间。你认为烧熔过早、过晚的后果是 。
四.(本题包括2小题,共20分)
19.(10分)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
⑴一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下。
![]()

水 热冰
使水结成“热冰”采用“弱电场”的条件,说明水分子是 分子。请你展开想象,给“热冰”设计一个应用实例 。
⑵用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是 。
②由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式 。
20.(10分)已知:A为常见金属,B是一种盐,C中A元素的质量分数为25.3%,K是一种重要的矿石,D、E、G、H常温下均为气体,L是红褐色固体。②、③、⑤均为工业生产中的重要反应。各物质间的相互转化关系如下图:(其中某些反应的部分生成物被略去)
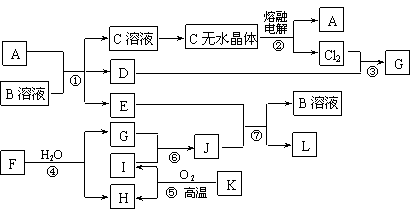 |
请按要求填空:
⑴工业生产中,实现反应⑤的设备是 。
⑵由“C溶液→C的无水晶体”需特定的气体氛围,该气体是上述转化关系中的 (填“字母”)。
⑶反应①的离子方程式为 ;
将J滴入沸水中的离子方程式为 。
⑷若反应④表示为“F+H2O=2G+H”,则可推知F的化学式___ __。
五.(本题包括1小题,共10分)
21.(10分)随着经济的发展和人民生活水平的提高,近年来我省汽车拥有量呈较快增长趋势。
⑴乙丙橡胶(![]() )因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
)因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
 ⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液——稀硫酸。写出该过程阳极反应的电极反应式
。
⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液——稀硫酸。写出该过程阳极反应的电极反应式
。
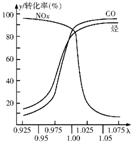
⑶在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是 。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为 。为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。已知:甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式 。
六.(本题包括2小题,共18分)
22.(8分)胡椒酚A是植物挥发油中的一种成分。某研究性学习小组对其分子组成结构的研究中发现:A的相对分子质量不超过150;A中C、O的质量分数分别为:w(C)=80.60%,w(O)=11.94%,完全燃烧后产物只有CO2和H2O。
根据以上信息,填写下列内容:
⑴A的摩尔质量为 。
⑵光谱分析发现A中不含甲基(-CH3),苯环上的一氯取代只有2种;1molA与足量溴水反应,最多消耗3molBr2。A的结构简式为 。
⑶A的一种同分异构体中,苯环上含有两个取代基,取代基位置与A相同,且能发生银镜反应。
①符合条件的A的同分异构体的结构简式 。
②上述A的一种同分异构体发生银镜反应的化学方程式 。
23.(10分)有机物F商品名称“敌稗(Propanil)”,是一种优良的水稻除草剂,现通过下列合成路线制备:
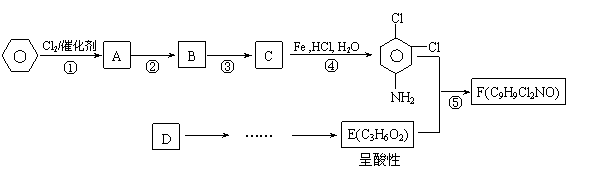 |
![]() 已知:
已知:
Ⅰ. (X表示卤素原子,下同)
Ⅱ.![]()
Ⅲ.当一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而取代邻位、对位或间位。使新的取代基进入它的邻位、对位的取代基:-CH3、-NH2、-X;使新的取代基进入它的间位的取代基有:-COOH、-NO2等。
请结合上述所给信息,回答问题:
⑴反应②条件 。
⑵有人认为:若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的。请你指出不妥之处 。
⑶反应⑤的化学反应方程式: 。
⑷请你设计D→E(C3H6O2)的合成路线。
要求:
①合成过程中无机试剂任选、有机原料碳原子不超过2个;②合成反应流程图表示方法示例如下:
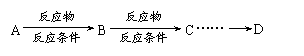 |
七.(本题包括2小题,共18分)
24.(8分)某结晶水合物含有两种阳离子和一种阴离子。现称取10.00g的该结晶水合物,配制溶液。向其中加入足量的稀Ba(OH)2溶液,有浅蓝色沉淀生成;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;将所得气体用100.0mL0.5000mol/L硫酸吸收,多余的硫酸用2.000mol/LNaOH溶液滴定,用去NaOH溶液25.00mL。用盐酸处理上述浅蓝色沉淀,经洗涤和干燥,得到白色固体11.65g。
⑴该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
⑵试通过计算确定该结晶水合物的化学式。
25.(10分)水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好著称,其生产原理示意如下:
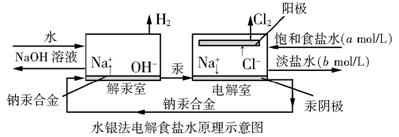
⑴分别写出电解池、解汞室中发生反应的离子方程式。
⑵当阳极产生3.36m3(标准状况)Cl2时,解汞室中生成NaOH的质量为多少千克。
⑶电解室中NaCl溶液的流入、流出速率均为VL/min,若生产上要求流出碱液的物质的量浓度为cmol/L,计算解汞室中碱液的流出速率Q(单位:L/min)。
⑷20世纪60年代,氯碱生产采用离子膜法,水银法逐渐被淘汰,你认为被淘汰的主要原因是什么?
参考答案
一.单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.D 2.B 3.C 4.D 5.A 6.C 7.D 8.B
二.不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.BC 10.A 11.AB 12.D 13.A 14.CD 15.C 16.AB
三.(本题包括2小题,共20分)
17.⑴除去碳酸钙等不溶性杂质
⑵检验HCO3—离子 另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢 (每空2分,共8分)
18.实验原理 FeSO4+H2C2O4+2H2O= Fe C2O4·2H2O+H2SO4
操作步骤
⑴草酸亚铁晶体的制备
①1L容量瓶、胶头滴管
②样品中可能含有Fe3+、蒸馏水未能事先处理、溶液配制时间较长
③取最后的洗涤液,测定洗涤液的pH,若洗涤液的pH等于7,说明已经洗涤干净
⑵纳米铁粉的制备
①驱赶装置中空气,防止红热的铁被氧化
②过早过晚都将导致所得纳米铁粉纯度不够(过早未能完全分解、过晚造成铁被氧化)
(每空2分,共12分)
四.(本题包括2小题,共20分)
19.⑴极性 建造室温溜冰场
⑵①水分子间存在氢键 ②2H2O++SO2==4H++SO42— H2O++H2O==H3O++—OH
(每空2分,共10分)
20.⑴沸腾炉 ⑵G ⑶Mg+2NH4+=Mg2++H2↑+2NH3↑ Fe3++3H2O(沸)=Fe(OH)3(胶体)+3H+
⑷SOCl2 (每空2分,共10分)
五.(本题包括1小题,共10分)
21.⑴CH2=CH2和CH3CH=CH2
![]() ⑵2Al+3H2O—6e—=Al2O3+6H+
⑵2Al+3H2O—6e—=Al2O3+6H+
⑶NOx(或氮氧化物) 2NOx+2xCO N2+2xCO2
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1);△H=-1452kJ/mol 每空2分,共10分)
 六.(本题包括2小题,共18分)
六.(本题包括2小题,共18分)
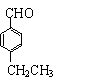 22.⑴134g/mol ⑵
22.⑴134g/mol ⑵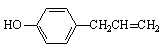 ⑶①
⑶①
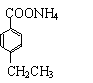 | |||
 | |||
② +2Ag[(NH3)2]OH → +2Ag↓+3NH3+H2O
(每空2分,共8分)
23.⑴H2SO4(浓△ (2分)
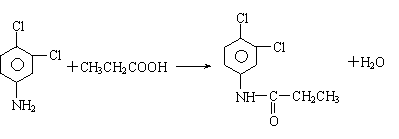 ⑵所得C的纯度不高
(2分)
⑵所得C的纯度不高
(2分)
⑶ (2分)
| |||||
| |||||
| |||||
![]()
![]()
![]() ⑷CH2=CH2
CH3CH2Br
CH3CH2CN
CH3CH2COOH(4分)
⑷CH2=CH2
CH3CH2Br
CH3CH2CN
CH3CH2COOH(4分)
七.(本题包括2小题,共18分)
24.⑴NH4+ Cu2+ SO42- (每空1分,共3分)
⑵解:n(NH4+)=n(NH3)= (2×100×10-3L×0.5mol/L—25L×10-3×2mol/L) =0.050mol
n(SO42—)=n(BaSO4)=![]() = 0.050mol
(2分)
= 0.050mol
(2分)
根据电荷守恒:
n(Cu2+)= n(SO42—)—![]() n(NH4+)=0.050mol—
n(NH4+)=0.050mol—![]() ×0.050mol=0.025mol
×0.050mol=0.025mol
根据质量守恒:
m(H2O)= 10g—0.050mol×96g/mol—0.050mol×18g/mol—0.025mol×64g/mol =2.7g
n(H2O)=![]() =0.15mol
(2分)
=0.15mol
(2分)
故该结晶水合物的化学式为(NH4)2Cu(SO4)2·6H2O。 (1分)
答:略。
25.⑴电解池:2Na++2Cl—![]() 2Na+Cl2↑
2Na+Cl2↑
解汞室:2Na+2H2O=2Na++2OH—+H2↑ (2分)
⑵解:n(NaOH)=
n(e—)=2 n(Cl2)=2×![]() =300mol=0.3kmol
=300mol=0.3kmol
m(NaOH)= 0.3kmol×40g/mol=12kg (3分)
⑶Q =(a-b)V/c L/min (3分)
⑷汞有毒性,对环境造成污染。 (2分)
答:略。
注:主观性试题中出现的合理答案均给分。