高考化学模拟试卷(二)
化 学
注意事项:
1.本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,共150分。考试时间120分钟。
2.请把第I卷的答案填涂在答题卡上,第II卷的答案写在答题卷的指定栏目内。
可能用到的相对原子质量:H—l Li一7 C—12 O—16 N—14 Na一23 Si一28
Cl一35.5 K一39 Ca一40 Cr一52 Ba一137
第I卷(选择题 共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
 1.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分 子。N4分子结构如右图所示,已知断裂1mol N—N吸收167kJ热量,生成1molN
1.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分 子。N4分子结构如右图所示,已知断裂1mol N—N吸收167kJ热量,生成1molN![]() N放出942kJ根据以上信息和数据,下列说法正确的是
N放出942kJ根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体 D.1molN4气体转变为N2将吸收882kJ热量
2.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电予的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
3.人们在禽流感疫区通常用到处洒石灰的做法消灭病毒,甚至是低矮树木的叶子上都洒上 了石灰,效果较好。根据有关化学知识,判断下列说法错误的是
A.由于石灰与水产生的氢氧化钙显碱性,可以使病毒蛋白失去活性
B.饱和石灰水中加入生石灰,在温度不变的情况下,pH不变
c.饱和石灰水中加入生石灰,在温度不变的情况下,Ca2+的物质的量不变
![]() D.给饱和石灰水溶液升高温度,c(OH一)的浓度降低
D.给饱和石灰水溶液升高温度,c(OH一)的浓度降低
4.某些毛绒玩具的内充物为无毒的聚酯纤维,其结构简式为:
下列说法正确的是
A.羊毛与聚酯纤维的化学成分相同 B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙醇 D.由单体合成聚酯纤维的反应属加聚反应
5.阿伏加德罗常数约为6.02×1023mol-1。下列叙述正确的是
A.60g SiO2与足量纯碱反应,高温下最多可释放出6.02×1023个气体分子
B.1mol碳正离子(CH3+)中含电子数目为10×6.02×1023
C.1mol油酸含有的双键数目约为6.02×1023
D.标准状况下,11.2L 四氯化碳所含分子数为0.5×6.02×1023
6.下列实验操作或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在中学“硫酸铜晶体里结晶水含量测定”的实验中,称量操作至少需要四次
C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
D.在250mL烧杯中,加入216mL水和24g NaOH固体,配制10%NaOH溶液
7.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的 烯烃复分解催化剂。工业上冶炼钼的化学原理为:

则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,能溶解于稀盐酸中
C.H2MoO4是一种强酸
D.用还原剂还原等质量的MoO3,消耗H2、CO和Al的物质的量之比为3:3:2
8.将KCl和CrCl3两种固体混合物共熔制得化合物X,X由K、Cl、Cr元素组成。将1.892gX中Cr元素全部氧化成Cr2O72-,Cr2O72-可从过量的KI中氧化出2.667g I2,反应的离了方程式是:Cr2O72-+6I-+14H+=2Cr3++3 I2 +7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3,可得4.520g AgCl沉淀,则表示x组成的化学式为
A.K3Cr2Cl9 B.K3Cr2Cl5 C.K3Cr2Cl7 D.K2CrCl4
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为O分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为O分)
9.下列离子方程式中错误的是
A.过量的NaHSO4与Ba(OH)2溶液反应:![]()
B.NH4HCO3溶液与过量NaOH溶液反应:![]()
C.苯酚钠溶液中通入少量CO2:![]()
D.FeBr2溶液中通入过量Cl2:![]()
10.下列物质的除杂方法:
①SO2中混有的SO3杂质可以让混合气体通过浓硫酸除去;
②MnO2中混有的少量有机物,可以用加热的方法除去;
③乙烯中混有的SO2气体可以通过溴水除去;
④金属铜中含有的少量银和锌可以通过电解精炼的方法除去;
⑤KNO3中含有的少量NaCl可以通过重结晶的方法除去。
其中合理的是
A.①②④⑤ B.①②③④ c.②③④⑤ D.①②③④⑤
11.w、x、Y、z为原子序数依次增大的同周期的短周期元素。已知w、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
A.w、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸
B.z元素在第三周期第VIA族
C.W、Y、Z三种元素有两种是金属、一种是非金属 D.W、X、Y三种元素的单质熔、沸点依次降低
12.下列各组离子能大量共存,当溶液中c(H+)=10-1 mol·L-1时,有气体产生;而当溶液中c(H+)=lO-13 mol·L-1时,又能生成沉淀。该组离子可能是
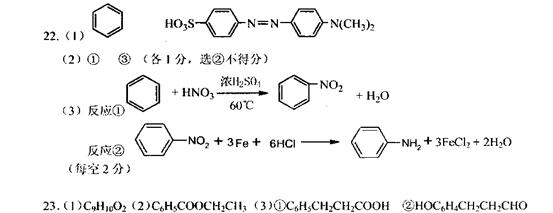
13.一些烷烃的燃烧热如下表:
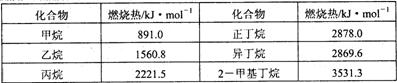
下列表达正确的是
A.正戊烷的燃烧热大约在3540 kJ·mol-1左右
B.热稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为:![]()
 D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
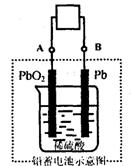
14.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,
电池总反应式为: ![]()
则下列说法正确的是
A.放电时:负极板上发生了还原反应
B.放电时:正极反应是![]()
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是![]()
15.下列关于溶液中离子的说法正确的是
A.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:![]()
B.O.1 mol·L-1的NH4Cl和O.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系:
![]()
C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系:
![]()
D.0.1 mol·L-1的NaHS溶液中离子浓度关系:![]()
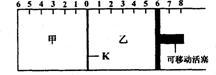 16.如下图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和lmolB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)
16.如下图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和lmolB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) ![]() 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
A.到达平衡时,甲容器中C的物质的量小于乙容器中C的物质的量
B.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
C.达到平衡后,隔板K最终停留在左侧刻度0~2之间
D.若平衡时K停留在左侧 1 处,则活塞仍停留在右侧6处
 第II卷(非选择题共86分)
第II卷(非选择题共86分)
三、(本题包括2小题,共22分)
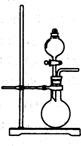
17.(lO分)(1)右图是实验室制取某些气体的装置。
①该制气装置在加入反应物前,应事先进行的操作是______。
②若用该装置制取O2,反应物除了可选择二氧化锰和_______(填试剂名称),
还能选择_____ (填物质的化学式)和水。
③利用该装置还可制取_____ (选填下列字母序号)等气体。
A.H2 B.CO2 C.C2H2 D.NH3
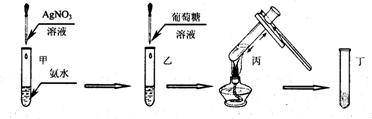 |
(2)试指出以下银镜反应实验过程示意图的错误之处(可不填满,也可自添空格)。
①______________________________;
②______________________________;
③______________________________;
18.(12分)某校化学兴趣小组经查阅资料得知:铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝亦有其特殊的性质:①铝的熔点是660℃,氧化铝的熔点高达 2054℃。②铝虽比锌活泼,但是将铝片和锌粒分别投入稀硫酸中,铝比锌反应慢得多。③尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,但“奇怪”的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组进行了“铝表面氧化膜”的实验,其过程如下,并请完成填空:
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的__________内层的铝并将其裹住,所以不易发生熔滴现象。
试写出灼烧铝的化学方程式:_______________________
(2)取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中其表面产生许多无色气泡,很快析出较多红色粉末状固体:而另一片浸入CuSO4稀溶液中现象一直不明显。试猜测产生这种现象差异的因素是___________________________________
(3)用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,2~3min后,铝片表面有气泡,并有少量红色固体附着。试写出铝片表面附着红色固体的离子方程式为________________________
(4)再取2条铝片,用砂纸擦去氧化膜,都浸入浓硝酸中,无显著变化,5min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象同(2)。铝片浸入浓硝酸中无显著变化的原因是________________________________________
(5)另取2条未用砂纸打磨过的铝片,都浸入氢氧化钠溶液中,片刻后其表面产生无色气泡,5min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象与(2)相似。试写出铝的氧化膜与碱液反应的离子方程式:________________________________________
(6)向步骤(2)、(4)和(5)中的CuSO4稀溶液中滴入3~5滴NaCl稀溶液,铝片表面逐渐产生气泡,且有红色固体析出。
因此据步骤(2)、(4)、(5)和(6)的现象可以得出的结论是________________________________________
四、(本题包括2小题,共18分)
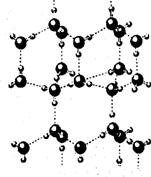 19.(8分)水分子间因存在“氢键”的作用而彼此结合形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
19.(8分)水分子间因存在“氢键”的作用而彼此结合形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
(1)1mol冰中有_____mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的微粒,
其电离方程式为______________________________
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),
则x、y、z的大小关系是_________________________
(4)实验测得冰中氢键的作用能为18.8 KJ·mol-1,而冰的
熔化热为5.0KJ·mol-1,这说明__________________________________________________
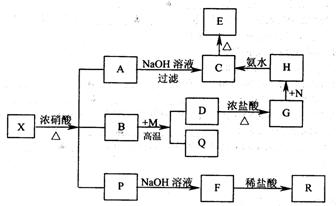 20.(10分)固体x是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:l。在一定条件卞x可发生如下框图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为混合气体,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。试填空。
20.(10分)固体x是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:l。在一定条件卞x可发生如下框图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为混合气体,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。试填空。
(1)X的化学式为_______________
P中气体的化学式为____________________
(2)实现G→H,欲不引进新的杂质,
N可以选择下列物质中的_________ (填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出下列反应的离子方程式:
D→G___________________________________ H→C___________________________________
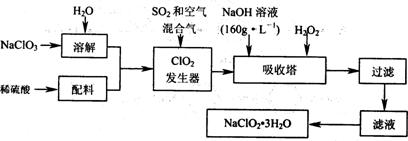 21.(10分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
21.(10分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
提示:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
③NaOH溶液(160g·L-1)是指:每升溶液中含溶质160g。
试填空。
(1)该NaOH溶液的物质的量浓度为__________mol/L 若要计算该溶液溶质的质量分数,还需要的一个条件是____________________
(2)在发生器中鼓入空气的作用可能是_______________ (填字母序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸。C.将NaClO3氧化成ClO2
(3)吸收塔的温度不能超过20oC,其目的是__________________________________________________
吸收塔内发生反应的化学方程式为______________________________________________________
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是___________________________________
(5)要得到更纯的NaClO2·3H2O晶体必须进行的操作是_________ (填操作名称)。
22.(10分)请阅读并思考下列四个反应:
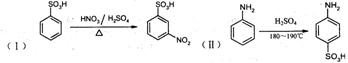
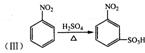
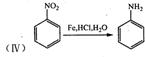
![]() 根据上述信息,按以下步骤(反应条件及有关试剂已略去)可以从烃A合成指示剂甲基橙。
根据上述信息,按以下步骤(反应条件及有关试剂已略去)可以从烃A合成指示剂甲基橙。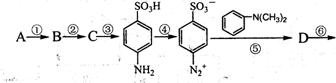
试填空。
(1)写出结构简式A________________、D________________:
(2)在反应①、②、③中属于取代反应的是________________ (填写序号);
(3)写出上述步骤中反应①、②相关反应的化学方程式:
_____________________________________ _____________________________________
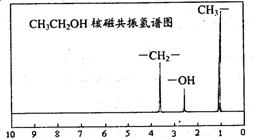
23.(8分)化合物A经李比希法测得其中含c 72.0%、H 6.67%,其余含有氧,质谱法分析得知A的相对分予质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪可以测定有机分子里不同化学环境的氢原子及其相对数量。如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比3:2:1,见下图所示。
现测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3(如左图)
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如右图:
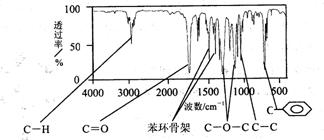
己知。A分子中只含一个苯环,且苯环上只有一个取代基,试填空。
(1)A的分子式为________________________ (2)A的结构简式为________________________
(3)A的芳香类同分异构体有多种,请按要求写出其中两种结构简式:
①分子中不含甲基的芳香酸:________________________
②遇FeCl3显紫色且苯环上只有两个取代基的芳香醛:________________________
七、(本题包括2小题,共18分)
24.(7分)某制药公司生产一种钙片,其主要成分是碳酸钙。为测定钙片中碳酸钙的质量分数,取一钙片碾碎后放入足量的盐酸中(假设钙片除碳酸钙之外的成分不与盐酸反应)过滤,取滤液加入足量的(NH4)2C2O4,使Ca2+全部生成CaC2O4沉淀,再过滤出沉淀并洗涤后将其溶解于强酸中,使其全部转化为草酸(H2C2O4),再稀释成1.00L溶液,取出该溶液20.0mL,然后用0.0100mol·L-1酸性KMnO4溶液滴定,恰好完全反应时用去6.00mL酸性KMnO4溶液。滴定时反应的离子方程式为
![]()
![]()
(1)滴定时是否需要指示剂?答:___________,理由是__________________________________________
(2)试计算每片钙剂中钙元索有多少毫克?
25.(11分)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机,这类材料中研究得较多的是化合物G。
(1)G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体,G的相对分子质量为140,分子中硅元素的质量分数为60%,另有元素J。请推断:
①化合物G的化学式为________________________
②若1mol NH3和0.75mol E恰好完全反应,则化合物E的化学式为________________________
(2)为了使化合物G能成为新一代汽车发动机材料,现采用常压下在其中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品叫“赛伦”(Sialon),化学通式可表达为Si6-xAlxOxJ8-x。在接近于1700oC时x的极限值约为4.0,在1400oC时x为2.0,以保持整个化合物呈电中性。试通过计算说明随温度的升高,赛伦中铝元素的质量分数的变化趋势。
参考答案



![]()
![]()
(4)连续测定吸收塔内的溶液PH值
(5)重结晶