高考化学周练试题十五
可能用到的相对原子质量:H—1,C—12,N—14,O—16,F—19,Na—23,Mg—24,Al—27,S—32,Cl—35.5,K—39,Fe—56,Cu—64, Ba—137
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意):
1、 “耐高温长寿命抗氧化陶瓷复合材料应用技术”获2004年度国家技术发明一等奖。该复合材料的强度比钢还大,在航空航天器中用来替代金属材料,可节约20~30%的燃料。下列关于该材料的叙述中不正确的是
A.该材料属于新型无机非金属材料 B.该材料的化学性质非常稳定
C.与金属一样有较好的传热性能 D.可以替代金属做耐高温结构材料
2、已知锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物叙述正确的是 ( )
A.Li2SO4难溶于水 B.Li与N2反应产物是Li3N
C.LiOH易溶于水 D.LiOH与Li2CO3受热都很难分解
3、KCl和KBr的混合物3.87g溶于水后,加入过量AgNO3溶液,共产生沉淀6.63g,则原混合物中钾元素的质量分数为( )
(A)24.1% (B)40.3% (C)25.9% (D)37.4%
4、要提纯下列物质(括号内物质为杂质),实验操作合理的是 ( )
A.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
B.苯(苯酚):加入足量的浓溴水,充分振荡,静置分层后分离
C.CO2(SO2):通入盛有Na2CO3溶液的洗气瓶
D.Mg(OH)2[Ca(OH)2]:放入水中调成浆状,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
5、下列无色澄清的溶液中,可能大量共存的离子组是 ( )
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.ClO-、Na+、AlO2-、S2-
6、设NA表示阿伏加德罗常数,下列叙述中不正确的是 ( )
A.在含196g H2SO4的浓硫酸中加入足量锌粉使其充分反应,则反应结束时转移电子数约为4NA
B.将162.5g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数小于NA
C.在12g石墨晶体中,所含的碳碳共价键数约为1.5NA
D.1mol C10H22分子中共价键总数约为31NA
7、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+1/2O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
8、足量浓硫酸加入a g铜,完全反应后放出b L气体;足量的盐酸中加入m g FeS,完全反应后放出V L气体(标准状况),已知二者所产生的气体恰好完全反应,则a:b:m:V应是( )
(A)40:14:110:7 (B)40:14:55:14
(C)20:7:55:14 (D)20:7:55:21
二、选择题(本题包括8小题,每小题4分,共32分,每小题有一个或两个选项符合题意,若正确答案是包括一个选项,多选时该题为0分;如果正确答案包括两个选项,只选一个且正确的可得2分,但只要选错一个,该小题就为0分):
9、下列离子方程式正确的是 ( )
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 +3H+ = Fe3+ +3H2O
B.Na2S溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.用漂白粉溶液吸收过量的二氧化碳:ClO—+H2O+CO2==HClO+HCO3-
D.将草酸溶液和少量烧碱溶液混合:H2C2O4+OH-==HC2O4—+H2O
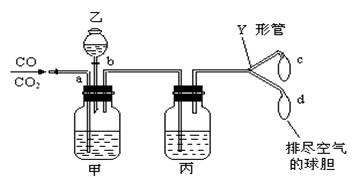 10、实验室用如下图所示的实验装置分离CO2和CO气体并干燥。图中a为止水夹,b为分液漏斗的活塞,通过Y形管分别接c、d两球胆。现在装置内的空气已排尽,为了使实验成功,甲、乙、丙分别盛放的溶液应该是
( )
10、实验室用如下图所示的实验装置分离CO2和CO气体并干燥。图中a为止水夹,b为分液漏斗的活塞,通过Y形管分别接c、d两球胆。现在装置内的空气已排尽,为了使实验成功,甲、乙、丙分别盛放的溶液应该是
( )
A.NaHCO3饱和溶液、2mol/L盐酸、18.4mol/LH2SO4溶液
B.18.4mol/LH2SO4溶液、NaOH饱和溶液、18.4mol/LH2SO4溶液
C.Na2CO3饱和溶液、2mol/LH2SO4溶液、NaOH饱和溶液
D.NaOH饱和溶液、2mol/LH2SO4溶液、18.4mol/LH2SO4溶液
11、500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol/L B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol/L
12、已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如下图:
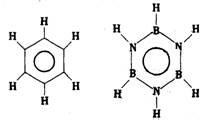
则硼氮苯的二氯取代物 B3N3H4CI2 的同分异构体的数目为
A.2 B. 3 C. 4 D. 6
13、将0.1mol/L KHSO4和0.1mol/L Na2S溶液等体积混合后,所得溶液能使pH试纸变蓝,则离子浓度关系正确的是 ( )
A.c(SO42-)>c(HS-)>c(OH-)>(H+)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=2c(S2-)+c(H2S)+c(HS-)+2(SO42-)
D.c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
14、如下图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)![]() aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
( )
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
( )
 |
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于V L
15、将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-离子,若将2.83 gX中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为 ( )
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.K2SO4·1/2Cr2(SO4)3
16、化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),以下结论不正确的是 ( )
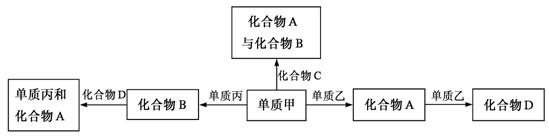
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体均是分子晶体
D.上图所示的五个转化关系中,均为放热反应
第II卷 非选择题(共86分)
三、(本题包括2小题,共20分):
17、(6分)下列有关实验的叙述,正确的是(填序号) (少一个扣2分,多一个倒扣2分,扣完为止)
A.用渗析法分离淀粉中混有的NaCl杂质
B.用碱式滴定管量取20.00mL高锰酸钾溶液
C.测定某溶液的pH时,将润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
D.用浓氨水洗涤做过银镜反应的试管
E.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
F.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分
G.在氢氧化铁胶体中加少量硫酸会产生沉淀
18、(14分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
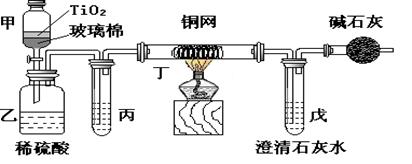
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
回答下列问题:
(1)甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水以除去HCl气体,那么丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
(3)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因 (只要回答出一点即可)。
(4)请你提出一个能够提高测量准确度的建议(注意:建议要有可操作性,且操作简单)
。
四、(本题包括3小题,共30分):
19、(8分)A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。单质C是一种黄绿色气体,A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种气体X,且X分子与B2A分子中的电子数相等。B与C可形成气体Y,且Y分子与最简式为BA的分子中的电子数相等。
请回答:
(1)写出DA2的化学式: ;写出最简式为BA的物质的电子式
(2)写出单质C与过量X反应的化学方程式
(3)写出B4A3D2的水溶液呈弱酸性的原因(用离子方程式表示)
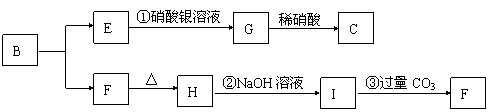
20、(8分)某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、而腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:
![]() ①B + NH3 C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解,得到A。
①B + NH3 C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解,得到A。
|
 |
请回答下列问题:
(1)写出化合物B和化合物G的化学式 、 。
(2)A可能所属的晶体类型是 ,在A晶体中,每个Si原子周围结合的另一种原子的个数是 。
(3)写出反应②的离子方程式: ;
(4)分析反应③,你能得出的结论是:
。(合理均计分)
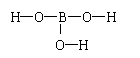
21、(14分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和以及防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)从题目信息可知硼酸应属于 酸(弱、强、中强);
(2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: 。
(3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol/LNaOH溶液恰好完全中和,据此推测硼酸在水溶液中呈酸性的原因是(用离子方程式表示) 。
写出硼酸与NaOH溶液反应的化学方程式: 。
(4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:
;
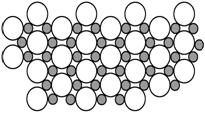 (5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为 ;
(5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为 ;
(6)硼烷(B2H6)气体在空气中能剧烈燃烧生成固态氧化物,已知每生成1mol液态水可放出722kJ的热量,请写热化学方程式: 。
五、(本题包括2小题,共18分):
22、(8分)有机物A与CH3COOH无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答下列问题。
(1)符合条件的相对分子质量最小的有机物A是 (写结构简式);
(2)若A与乙酸相对分子质量相等,则A的结构简式可以是 ;
(3)若A中C、H元素质量分数之和为86.67%,其余为O,A的分子量小于200,则A的分子式为
。如果A中含苯环结构且能发生银镜反应,符合条件的A的同分异构体有
(写两个即可)。
23、(10分)有机物A、B、C、D、E、F、G的相互转化关系如图所示。5.2g F能与100mL1mol/LNaOH溶液恰好完全中和,0.1mol F还能与足量金属钠反应,在标准状况下放出2.24L H2。D的分子式为C3H3O2Na,能使溴水褪色,E的分子中含有羧基。试回答:
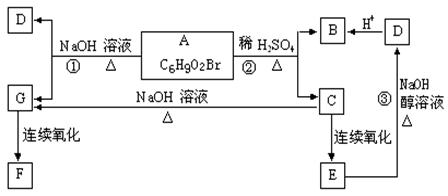
(1)写出下列物质的结构简式:
F D
(2)写出下列反应的反应类型:
反应② 反应③
(3)写出下列反应的化学方程式:
B与溴水反应:
反应①:
六、(本题包括2小题,共18分):
24、(8分)将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868g/cm3氨水。
(1)求所得氨水的物质的量浓度?
(2)取上述氨水30.0mL与70.0ml 2.00mol/L的AlCl3溶液相混合,产生的白色沉淀的质量是多少?
(3)往上述反应后未过滤的溶液中加入一定体积的5mol/L的NaOH溶液后,混合后体系中沉淀的质量与上述(2)中产生的沉淀质量相等,求加入的NaOH溶液的体积是多少?
25、(10分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是____________和____________,阴离子是_____________。
(2)试通过计算确定该结晶水合物的化学式。
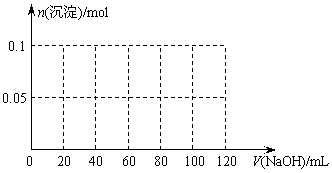
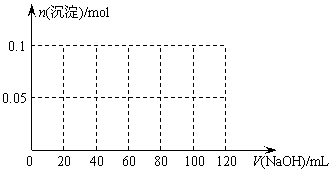
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol/L,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
周练十五
化 学 参 考 答 案
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意):
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | C | B | B | D | A | A | D | C |
二、选择题(本题包括8小题,每小题4分,共32分,每小题有一个或两个选项符合题意,若正确答案是包括一个选项,多选时该题为0分;如果正确答案包括两个选项,只选一个且正确的可得2分,但只要选错一个,该小题就为0分):
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 | CD | D | AB | A | AC | C | CD |
三、(本题包括2小题,共20分):
17、(6分)AEG(少一个扣2分,多一个倒扣2分,扣完为止)
18、(14分,每空2分)
(1)CN-+ClO-CNO-+Cl- 2CNO-+2H+ +3ClO-N2↑+2CO2↑+3Cl-+H2O
(2)除去Cl2 防止空气中CO2进入戊中影响测定准确度
(3)82% ①装置乙、丙、丁中可能滞留有CO2;②CO2产生的速度较快未与戊中的澄清石灰水充分反应 ;③Cl2、HCl在丙、丁中未吸收完全。(三点中任意答一点即可)
(4)建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;建议二:乙中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多的与Ca(OH)2反应。建议三:将戊中澄清石灰水改为浓度较大的NaOH溶液,反应结束后向戊中加入足量CaCl2后测沉淀质量。等等 (三点中任意答一点即可)
四、(本题包括3小题,共30分):
![]() 19、(8分,每空2分)
19、(8分,每空2分)
(1)NO2
(2)3Cl2+8NH3=N2+6NH4Cl
(3)NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
20、(8分,每空2分)
(1)SiCl4、AgNO3 (2)原子晶体,4 (3)SiO2 + 2OH- SiO32- + H2O
(4)H2CO3的酸性比H2SiO3强,或C的非金属性比硅强等。
21、(14分,每空2分)
 (1)弱(2分)
(1)弱(2分)
(2) (2分)
(3)B(OH)3+H2O![]() [B(OH)4]-+H+(2分)
B(OH)3+NaOH=NaBO2+2H2O
(2分)
[B(OH)4]-+H+(2分)
B(OH)3+NaOH=NaBO2+2H2O
(2分)
(4)B(OH)3+3CH3OH![]() B(OCH3)3+3H2O
(2分)
B(OCH3)3+3H2O
(2分)
(5)MgB2(2分)
(6)B2H6(g)+3O2(g)
= B2O3(s)+3H2O(l);![]() H=-2166kJ/mol(2分,状态、系数等错误均不得分)
H=-2166kJ/mol(2分,状态、系数等错误均不得分)
五、(本题包括2小题,共18分):
22、(8分,每空2分)
(1)HCHO
(2)CO(NH2)2(或HOCH2CHO、HCOOCH3等,只要写出一个即可)
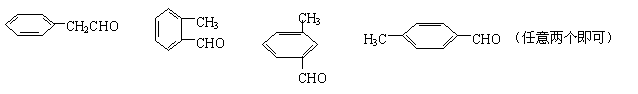 (3)C8H8O
(3)C8H8O
23、(10分)
(1) HOOC—CH2—COOH (2分) CH2=CH—COONa (2分)
(2) 水解反应 (1分) 消去反应 (1分)
(3) CH2=CH—COOH+Br2→CH2Br—CHBr—COOH (2分)
CH2=CHCOOCH2CH2CH2Br+2NaOH→CH2=CHCOONa+CH2OH—CH2CH2OH+NaBr (2分)
六、(本题包括2小题,共18分):
24、(8分)
(1)4 mol/L (2分) (2)3.12g (3分) (3)104mL(3分)
25、(10分)
(1)NH4+ Al3+ SO42- (3分,每空1分)
(2)n(SO42—)=![]() =0.2mol n(NH4+)=
=0.2mol n(NH4+)=![]() =0.1 mol
=0.1 mol
根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42—)可得:
n(Al3+)=![]() (2×0.2mol-0.1 mol)=0.1 mol
(2×0.2mol-0.1 mol)=0.1 mol
n(H2O)=![]() =1.2mol
=1.2mol
所以,该结晶水合物的化学式为NH4 Al (SO4)2·12H2O [或(NH4)2SO4·Al2(SO4)3·24H2O](3分)
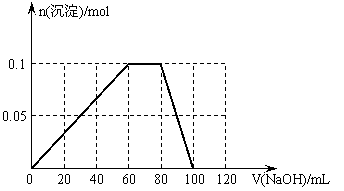 (3)
(3)
(4分)
答题纸
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
三、(本题包括2小题,共20分):
17、(6分)
18、(14分)(1) (2分)
(2分)
(2) (2 分)
(2分)
(3) (2分)
(2分
(4)
(2分)
四、(本题包括3小题,共30分):
19、(8分)(1) (2分) (2分)
(2) (2分)
(3) (2分)
20、(1) 、 。(2分)
(2) , 。(2分)
(3) ;(2分)
(4) (2分)
。(合理均计分)(2分)
21、(14分)(1) (2分)
(2) (2分)
(3) (2分)
(2分)
(4) (2分)
(5) (2分)
(6) (2分)
五、(本题包括2小题,共18分):
22、(8分)(1)① (2分)
(2) (2分)
(3) (2分)
![]() (2分)
(2分)
23、(10分)(1)F (2分)
D (2分)
(2)反应② (1分)
反应③ (1分)
(3) (2分)
(2分)
六、(本题包括2小题,共18分):
24、(8分)
25、(10分)(1) (1分) (1分) (1分)
(2)(3分)
(3)(4分)