高考化学最后精题精练(15项)
近年来,高考化学第Ⅰ卷的选考查的基本内容中,对重现率几达到100%的题型,在高考的最后冲刺阶段,我们作了全面的归纳和整理,以帮助学生在高考中确保零错误。这些题型主要有:
一、新科技 新材料 新能源 新发现
1.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
2.科学家将液态的金属镓(Ga)充入碳纳米管中,发明出一种世界上最小的温度计——碳纳米管温度计.该温度计通过电子显微镜进行读数,精确度较高,其测量范围在18℃~490℃.下列说法错误的是( )
A.常温常压下镓为液体 B.金属镓的体积在10℃~500℃之间随温度的变化比较均匀
C.碳纳米管的体积在10℃~500℃之间随温度的变化很小,可忽略不计
D.Al(OH)3、Ga(OH)3均是两性氢氧化物
3在20世纪90末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是( )
A.金刚石和石墨的熔点肯定要比C60高
B.熔点比较:C60<C70<C90;金刚石<石墨
C.球碳分子,管状碳分子、洋葱状碳分子,都是分子晶体,都是碳的同素异形体
D.金刚石、石墨晶体为非分子形式的粒子存在,属原子晶体;C60、C70、管状碳分子和洋葱状碳以分子形式粒子存在,属分子晶体。两类不是同素异形体。
4、最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体是叙述错误的是( )
A、晶体的熔沸点高、硬度大 B、晶体中C原子与C—O键键数之比1:4
C、晶体的空间最小环共有12个原子所构成 D、该晶体的化学式为CO4
5、“信息”、“材料”和“能源”被称为新科技革命的三大支柱。下列有关资讯错误的是D
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C.2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料
D.合成高分子材料的广泛应用是有百利而无一害
二、生活、生产、环境、农、工、医
1、在日常生活中,雪碧、可口可乐等饮品都是塑料容器盛装,而盛啤酒的容器却是玻璃制品,很少见到用塑料瓶盛装啤酒,这是由于塑料 ( )
A.造价太高同时形成白色垃圾而引起环境污染
B.太软,饮用和运输时都很不方便
C.相对玻璃透气性强,啤酒易被氧化而变质
D.属有机物,能与啤酒互溶而不与雪碧、可口可乐等饮品互溶
2、2005年11月13日中国石油吉林石化公司双苯厂发生爆炸事故,大量硝基苯泄漏,引起松花江水污染,安全生产和环保问题再次引起人们的关注。下列关于硝基苯的叙述正确的是( )
A.硝基苯是一种油状物质,会浮在水面上 B.实验室制硝基苯需要用水浴加热
C.硝基苯中毒是由蒸气吸入或误食引起的,与皮肤接触不会引起中毒
D.硝基苯是由苯酚和硝酸直接反应生成的
3、在2004年至2005年中,化学工作者和社会各界都一直关注食品安全问题,如“苏丹红1号”、“食品添加剂”、“火腿肠中保鲜剂”、“油炸薯类食品中的丙烯酰胺”等等。下列关于食品安全方面的说法正确的是 ( )
A.“苏丹红1号”的结构式为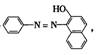 属于甲苯的同系物,能使酸性KMnO4溶液褪色;
属于甲苯的同系物,能使酸性KMnO4溶液褪色;
B.高温油炸食品中含有一定量的CH2=CH-CO-NH2(丙烯酰胺),该物质能在一定条件下发生缩聚反应生成高分子化合物;
C.食品添加剂中种类很多,其中的一种为苯甲酸钠,它是苯的同系物的一种所对应的钠盐;
D.火腿肠中保鲜剂通常用NaNO2,起抗氧化作用而达到保鲜的目的。
4、下列工业生产的说法错误的是( )
A. 氯碱工业中隔离两电极的材料是阳离子交换膜,因此该生产方法又称“阳离子交换膜法”
B. 生产普通玻璃的主要原料及设备:石灰石、石英、纯碱及玻璃熔炉
C. 由于常压下SO2转化为SO3的转化率很高,所以SO2接触氧化时不采用高压的反应条件
D. 合成氨的反应是放热反应,因此工业合成常采用低温条件
5、达菲(Tamiflu)被认为是目前世界上公认的能够治疗人禽流感病的唯一有效的药物,它是由我国特有中药材八角的提取物——莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构式如下:
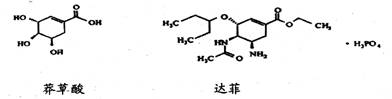
下列判断正确的是 ( )
A.它们互为同系物 B.莽草酸能使溴的四氯化碳溶液褪色,达菲不能
C.达菲在热的NaOH溶液中能稳定存在 D.莽草酸的分子式为C7H10O5
三、原子结构 物质结构 晶体结构
1、科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子,关于该元素的下列叙述正确的是( )
(A)其原子核内中子数和质子数都是112
(B)其原子核内中子数为165,核外电子数为277
(C)其原子质量是12C原子质量的277倍
(D)其原子质量与12C原子质量之比为277∶12
2、某氯原子的质量是a g ,12C原子的质量是bg ,用NA表示阿伏加德罗常
数,下列说法中正确的是( )
A.氯元素的相对原子质量为 12b/a
B.m g该氯原子的物质的量一定是m/(a NA) mol
C.该氯元素的摩尔质量是aNA
D.n g该氯原子所含的电子数为17n/b
3、不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理 学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
A.34S原子核内的中子数为16 B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
4、最近,美国Lawrece Lirermore国家实验室(LINL)的V·Lota·C·S·Yoo和H·cyrnn成功地在高压下将CO2转化具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是( )
A.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
B.CO2的原子晶体和CO2分子晶体具有相同的物理性质和化学性质
C.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子跟两个C原子相结合
D.CO2的原子晶体和分子晶体互为同分异构体
5、下列说法中正确的是( )
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C.金属离子和自由电子间通过金属键形成的晶体是金属晶体
D.CO2与SiO2都是分子晶体,所以它们有接近的熔、沸点
四、元素周期表 元素周期律
1、X、Y为短周期元素,X原子各电子层的电子数比为1:4:1,它比Y原子多3个电子。下列叙述正确的是:( )
A.X离子半径大于Y离子半径
B.X单质在空气中燃烧可生成两种化合物
C.X、Y形成的化合物与浓硫酸共热可在烧瓶中进行
D.电解X、Y形成的化合物的水溶液可得Y的单质。
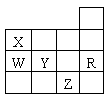 2、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
2、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物沸点比X的氢化物的沸点高
五、有关阿伏加德罗常数的判断和计算
1、NA代表阿伏加德罗常数值,下列说法正确的是( )
(A)9g重水所含有的电子数为5NA
(B)1molMgCl2中含有离子数为NA
(C)7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
(D)1molC10H22分子中共价键总数为31NA
2、下列有关阿伏加德罗常数的叙述正确的是( )
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体22.4L所含分子数为NA个
(B)1mol冰醋酸中含有6.02×1023个CH3COO━
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就得到1mol电子
(D)标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为![]()
3、设NA为阿伏加德罗常数值,下列叙述中不正确的是( )
A.12.4g白磷晶体中含有的P—P键数是0.6NA
B.2.9g2CaSO4·H2O 含有的结晶水分子数为0.02 NA
C.100 g的98%的浓 H2SO4中所含的硫原子数为2NA
D.2molSO2和1molO2 混合在V2O5存在的条件下密闭容器中加热反应后,容器内物质分子数大于2 NA
六、氧化还原反应
1、已知 I—、Fe2+、SO 2、Cl—和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为 Cl—< Fe 2+< H2O 2 < I—< SO 2,则下列反应不能发生的是( )
(A)2Fe3++SO2+2H2O=2Fe2++SO42—+4H+ (B)I2+SO2+2H2O=H2SO4+2HI
(C)H2O2+H2SO4=SO2+O2+2H2O (D)2Fe2++I2=2Fe3++2I—
2. 将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A. 气体A为SO2和H2的混合物
B. 气体A中SO2与H2的体积比为4:1
C. 反应中共消耗Zn 97.5g
D. 反应中共转移电子3mol
3、羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平)),则在上述反应中,羟胺的氧化产物是( )
(A)N2 (B)N2O (C)NO (D)NO2
七、热化学方程式的书写及正误判断;有关热化学方程式的简单计算
1、下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);ΔH= +119 kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);ΔH= -285.8 kJ/mol
2、已知H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是( )
A.Q1<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
3、已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为:
CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l);ΔH= +Q1 kJ/mol
CuSO4(s)+5H2O(l);ΔH= +Q1 kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为( )
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法比较
4、已知31g白磷变成31g红磷放出18.39KJ热量,下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s) △H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s) △H= -Q2 KJ/mol
Q1和Q2的关系为( )
(A)Q1>Q2 (B)Q1=Q2 (C)Q1<Q2 (D)无法确定
5、一种化学冰袋含有![]() ,用时将它们混台并用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测肯定错误的是:
,用时将它们混台并用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测肯定错误的是:
A.![]() 脱水是吸热过程( )
脱水是吸热过程( )
B.较长时间制冷是由于![]() 脱水较慢的过程
脱水较慢的过程
C.铵盐在该条件下发生的复分解反应是吸热反应
D.![]() 溶于水会吸收热量
溶于水会吸收热量
八、离子方程式的书写及正误判断
1、下列离子方程式正确的是( )
A.等物质的量的Ba(OH)2与明矾溶液混合:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
2、下列反应的离子方程式正确的是( )
(A)金属钠跟水反应:Na+2H2O=Na++2OH—+H2↑
(B)在漂白粉溶液中通入过量SO2 :ClO¯+SO2+H2O=HSO3━+HClO
![]()
![]()
3、下列离子方程式错误的是( )
(A)将少量SO2气体通入NaClO溶液中
SO2+2ClO-+H2O==SO![]() +2HClO
+2HClO
(B)在硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7
2H++SO![]() +Ba2++2OH-==BaSO4↓+2H2O
+Ba2++2OH-==BaSO4↓+2H2O
(C)小苏打溶液和甲酸混合
HCO![]() +HCOOH
= HCOO-+CO2↑+H2O
+HCOOH
= HCOO-+CO2↑+H2O
(D)澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO![]() ==CaCO3↓+H2O
==CaCO3↓+H2O
4、下列离子方程式正确的是( )
A.向碘化亚铁溶液中通入少量氯气 2Fe2++Cl2=2Fe3++2Cl-
B.向次氯酸钙溶液中通入过量二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.向硫酸氢钠溶液中滴入氢氧化钠溶液至中性 H++SO![]() +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
D.将氢氧化铁粉末加入氢碘酸中 Fe(OH)3+3H=Fe3++3H2O
九、判断溶液中的离子能否大量共存
1、在下述条件下,一定能大量共存的离子组是( )
A.无色透明的水溶液中:K+、Mg2+、I-、MnO4-
B.pH=1的NaNO3水溶液中:NH4+、Fe2+、SO42-、Cl-
C.c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br-
D.由水电离产生的c(OH-)=1×10-14mol/L的溶液中:H+、Al3+、Cl-、NO3-
2、下列各种溶液中,能大量共存的无色透明的离子组( )
A.使PH=0的溶液: Fe2+ 、NO3-、SO42-、I-
B.C(H+)=10-14mol· L-1的溶液中:Na+ 、AlO2-、S2-、SO32-
C.酸性环境下:Na+ 、 Cu2+ 、NO3-、SO42-、
D.使紫色石蕊试液变红的溶液中:K+ 、Na+ 、Ca2+ 、HCO3-
3、常温下,某溶液中由水电离产生的c[H+]、C(OH-)满足c(H+)·c(OH+)=10-24,则下各
离子在该溶液中一定可以大量共存的是( )
A.K+ Na+ AlO2- Cl- B.Na+ Cl- SO42- HCO3-
C.NH4+ Na+ NO3- SO42- D.Ba2+ Na+ Cl- NO3-
十、化学反应速率与化学平衡
![]() 1、可逆反应:2NO2 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
1、可逆反应:2NO2 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2 nmolNO2
②单位时间内生成n molO2的同时生成2 nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(A)①④⑥ (B)②③⑤ (C)①③④ (D)①②③④⑤⑥
![]() 2、在体积、温度都相同的条件下有如下反应:2A(气)+2B(气) C(气)+3D(气)。现分别从两条途径建立平衡:(Ⅰ)A、B的起始物质的量均为2mol;(Ⅱ)C、D的起始物质的量分别为2mol和6mol。以下叙述正确的是( )
2、在体积、温度都相同的条件下有如下反应:2A(气)+2B(气) C(气)+3D(气)。现分别从两条途径建立平衡:(Ⅰ)A、B的起始物质的量均为2mol;(Ⅱ)C、D的起始物质的量分别为2mol和6mol。以下叙述正确的是( )
(A)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
(B)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
(C)达到平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vD
(D)达到平衡时,Ⅰ途径所得混合气体的密度为Ⅱ途径所得混合气体密度的1/2
![]() 3、右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( )
3、右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( )
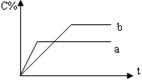 (A)a表示有催化剂,而b无催化剂
(A)a表示有催化剂,而b无催化剂
(B)若其他条件相同,a比b的温度高
(C)若其他条件相同,a比b的压强大,n>2
(D)反应由逆反应方向开始
4、温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+ B(g)![]() 3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是( )
3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是( )
A.C为非气态 B.C为气态
C.第二次达到平衡时C为气态 D.第三次达到平衡时C为非气态
 5、在一定条件下,固定容积的密闭容器中反应:2NO2(g)
5、在一定条件下,固定容积的密闭容器中反应:2NO2(g)![]() O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
A、当X表示温度时,Y表示NO2的物质的量
B、当X表示压强时,Y表示NO2的转化率
C、当X表示反应时间时,Y表示混合气体的密度
D、当X表示NO2的物质的量时,Y表示O2的物质的量
十一、弱电解质的电离平衡
1、MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化 如右图所示。下列叙述中不正确的是( )
A、 ROH是一种强碱 B、在x点,MOH完全电离C、在x点,c(M+)=c(R+)
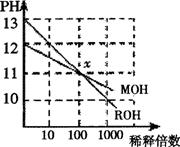 D、稀释前,c(ROH)=10c(MOH)
D、稀释前,c(ROH)=10c(MOH)
2、pH相同的盐酸和醋酸溶液分别和锌反应,若最后锌都
已完全溶解,但放出的气体一样多,则下列判断正确的( )
(A)整个反应阶段平均反应速率:醋酸>盐酸
(B)反应所需时间:醋酸>盐酸
(C)参加反应的锌的质量:醋酸=盐酸
(D)开始反应速率:盐酸>醋酸
十二、水的电离和溶液的pH的简单计算
1某温度下,O.1 moL/L醋酸溶液的pH=3。将该温度下O.2 moL/L醋酸溶液和O.2 mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7。下列说法正确的是( )
A.该温度下,O.01 mol/L醋酸溶液的pH=4
B.该温度下,用PH=3醋酸和PH=4醋酸分别完全中和等体积等浓度的NaOH溶液,消耗两醋酸的体积比为 <l:10
C.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH < 4.7
D.该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH = 4.7
2、在某未知溶液中加入醋酸钠晶体后测得溶液中c(Na+)与C(CH3COO-)之比等于1:1,
对原来未知溶液的判断正确的是( )
A、可能是强酸溶液 B、可能是强碱溶液 C、可能是中性溶液 D、难以确定
3、常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH—)=b mol 。a、b正确的答案组合是( )
A.9~11之间;0.1 B.9~11之间;0.2
C.12~13之间;0.2 D.13;0.1
十三、盐类的水解及离子浓度大小的比较
1、已知一种[H+]=1×10-3mol/L的酸和一种[OH—] = 1×10-3mol/ L的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
(A)浓的强酸和稀的强碱溶液反应 (B)浓的弱酸和稀的强碱溶液反应
(C)等浓度的强酸与弱碱溶液反应 (D)生成了一种强酸弱碱盐
2、下列混合液中,各离子浓度的大小顺序正确的是( )
A.10ml.1mol/LNIH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1—)>c(OH—)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl—)>c(NH4+)>c(OH—)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2moL/LNaOH溶液混合,
c(Na+)>c(CH3COO-)>c(OH—)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl—)>c(Na+)>c(OH—)>c(H+)
3、某二元弱酸的酸式盐NaHA溶液,若PH<7,则溶液中各离子的浓度关系不正确的是( )
A.c (Na+) > c (HA—) > c (H+) > c (A2—) > c (OH—)
B.c (Na+) + c (H+) = c (H—) + 2c(A2—) + c (OH—)
C.c (H+) + c (A2—) = c (OH—) + c (H2 A)
D.c (Na+) == c (HA—) + c (H2 A) + 2 c (A2—)
十四、电化学部分
1. 制H2O2过程中,先用电解NH4HSO4(以昂贵的铂作电极)得到过二硫酸。
![]()
阴极:2H3O++2e-→H2↑+2H2O
然后过二硫酸水解,最后可以制得H2O2。第一步水解 H2S2O8+H2O—→H2SO4+H2SO5 第二步水解 H2SO5+H2O—→H2SO4+H2O2,则要制得1mol H2O2,电解时转移电子数为( D )
A.0.5mol B.1mol C.1.5mol D.2mol
2、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是( )
A.负极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
十五、化学实验基础部分
1、下列有关说法正确的是( )
A.溴乙烷水解后的碱性溶液不能用硝酸酸化,因为硝酸会把Br—氧化,再加入AgNO3溶液则不会产生浅黄色沉淀
B.为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色
D.检验溶液中是否含有SO42-时,在无其它阳离子干扰时,所加的BaCl2溶液用盐酸酸化
2.下列各组中的实验不能达到预期目的的是( )
A.用浓硫酸与溴化钠强热制溴化气气体
B.用盐酸酸化的硝酸钡检验亚硫酸钠是否被氧化
C.用新制氢氧化铜鉴别葡萄糖、甲醛和甲酸溶液
D.用溴水鉴别苯、苯酚和苯乙烯
3、进行化学实验必须注意安全,下列几种处理事故的方法正确的是 ( )
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干 ②苯酚酒到皮肤上,用Na2CO3溶液洗涤
③酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭
④误食重金属离子,喝煮沸过的鲜牛奶 ⑤镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火
⑥实验时不慎被玻璃划破手指,引起轻微流血时,用三氯化铁溶液涂抹止血
A.全部正确 B,只有②③④⑤正确 C.只有⑥正确 D.全部错误
4、在一无色溶液中,可能存在Na+、Mg2+、Fe3+、I-、CO32-、SO42-、Cl-离子中的几种,某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加AgNO3溶液,有白色沉淀产生;(3)另一份加BaCl2溶液,有白色沉淀产生。则原溶液中一定大量存在的离子组是 ( )
A.Na+、Fe3+、SO![]() B.CO
B.CO![]() 、Cl-、SO
、Cl-、SO![]() C.Mg2+、I-、SO
C.Mg2+、I-、SO![]() D.Na+、SO
D.Na+、SO![]() 、CO
、CO![]()
答案: 一C、D、D、D、D 二C、B、D、D、D 三 D、B、B、C、C 四B、C
五 D、A、B 六CD、D、B 七C、A、A、A、C 八 A、D、A、C 九 C、B、D
十 A、AD、BC、CD、AB 十一 A、AD、BC、CD、AB 十二 B、B、B
十三 B、A、CD 十四 D、C 十五D、AB、C、D