高考化学模拟卷(一)
相对原子量: H-1 C-12 N-14 O-16 S-32 Ca-40 Fe-56 Cu-64 Na-23 He-4 Cl-35.5
第Ⅰ卷(共66分)
一、 选择题(本题共10分,每小题2分,只有一个正确选项)
1.下列物质不必放在棕色试剂瓶中的是 ( )
A.盐酸 B.AgI C.HNO3 D.新制的氯水
2.一种新型材料B4C,它可用于制作切削工具和高温热交换器。有关B4C的推断,正确的是 ( )
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是由4个硼原子和1个碳原子构成
3.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止富脂食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质。下列不属于抗氧化物质的是( )
A.生石灰 B.还原铁粉 C.亚硫酸钠 D.硫酸亚铁
4.下列各项中表达正确的是 ( )
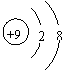 | |||
A.F—的结构示意图: B.乙炔的分子模型示意图:
C.NaCl的电子式:![]() D.乙酸的结构简式:C2H4O2
D.乙酸的结构简式:C2H4O2
5.下列说法中,正确的是 ( )
A.CO有毒,生有煤炉的居室,可放置数盆清水,能有效的吸收CO,防止煤气中毒
B.禽流感是一种传染病,高温蒸煮不能杀灭禽流感病毒
C.油条制作时常加入明矾[KAl(SO4)2]作膨化剂,以补充人体所需要的微量元素
D.薯片、薯条等淀粉类油炸食品中丙烯酰胺(CH2 = CHCONH2)含量较高,应谨慎食用
二、选择题(本题共36题,每小题3分,只有一个正确选项)
 6.对于右图所示装置的叙述正确的是
6.对于右图所示装置的叙述正确的是
A.Zn为正极,电极上有氢气放出
B.Cu为正极,发生氧化反应
C.这是一个原电池的装置,Cu为正极,Zn为负极
D.这是电解稀硫酸的装置,Cu为阳极,Zn为阴极
7.下列每组物质发生状态变化时,所克服的粒子间的相互作用属于同类型的是 ( )
A.食盐和蔗糖熔化 B.钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
8.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解 B.水结成冰体积膨胀
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
9.某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是 ( )
A.Mg2+、Al3+、HCO3—、SO32- B.K+、Ca2+、MnO4-、Cl-
C.NH4+、Fe3+、SO42- 、SCN- D. Ba2+、Na+、AlO2-、NO3-
10.相同状况下:H2(g)+1/2O2(g)®H2O(g)+Q1KJ/mol;2H2(g)+O2(g)®2H2O(1)+Q2KJ/mol,则Q1和Q2的关系为 ( ) A.Q1>Q2 B.Q1=Q2 C.2Q1<Q2 D.Q1= Q2/2
11.运用元素周期表知识分析下面的推断,其中错误的是 ( )
A.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体
B.硒化氢(H2Se)是无色、有毒比H2S稳定的气体
C.砹单质是一种有色固体,砹化氢(HAt)很不稳定
D.甲硅烷(SiH4)是一种易自燃、不稳定的气体
12.下列试验中,仪器的下端必须插入液面以下的是 ( )
制备氢气的简易装置中的长颈漏斗;‚制备氯气装置中的分液漏斗;ƒ制备Fe(OH)2操作中的胶头滴管;„将氯气溶于水时的导管;…用乙醇制取乙烯时的温度计;†分馏石油时的温度计。 ( )
A. ƒ„… B.‚ƒ„† C. ‚ƒ… D.全部
13.CO、H2与CH2O(g)的混合气体10g在氧气流中充分燃烧后,在150oC时将生成的混
合气体通过足量的Na2O2后,Na2O2固体的质量增重 ( )
A.2g B.5g C.15g D. 10g
![]() 14.在一固定体积的密闭容器中,可逆反应nA(g)+mB(g) pC(g)(n+m>p,正反应为放热反应)达到平衡状态。下列分析中,正确的是
( )
14.在一固定体积的密闭容器中,可逆反应nA(g)+mB(g) pC(g)(n+m>p,正反应为放热反应)达到平衡状态。下列分析中,正确的是
( )
升温c(B)/ c(C)的值变小;‚降温,平衡体系内混合气体的平均相对分子质量变小;ƒ增加B的物质的量,A的转化率增大;„使用催化剂,气体总的物质的量不变;…加压使密闭容器的容积变小,A或B的浓度都变大;†若A的反应速率为ν(A),则ν ( (B)=nν(A) /m
A.ƒ„… B.‚ƒ„ C.„…† D.‚ƒ
15.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NzHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-) D.c(Na+)=c(HRO3-)=c(RO32-)
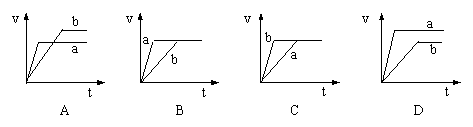 |
16.将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是 ( )17.将26.4g Mg、Cu组成的混合物投入到适量的稀硝酸中,固体完全溶解,收集到NO气体8.96L(S.T.P),向反应后的溶液中加入过量的4 mol/L的NaOH溶液300 mL,金属离子完全沉淀.则形成沉淀的质量是 ( )
A.43.2g B.46.8g C.53.6g D.63.8g
三、(本题共20分,每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个选项的,选对一个给2分,选错一个该小题不给分)
18.NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.9.2gNO2和N2O4混合气体中含有的原子数为0.6NA
B.标准状况下,11.2L SO3中含有的电子数为20NA
C.1 L 0.5 mol/L的(NH4)2SO4溶液中含有NA个NH4+
D.23gNa与足量的O2反应生成Na2O和Na2O2混合物时,共失去的电子数为NA
19. 为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
20.下列离子方程式书写正确的是 ( )
![]() A.硫酸镁溶液和氢氧化钡溶液反应: SO42-+Ba2+ BaSO4↓
A.硫酸镁溶液和氢氧化钡溶液反应: SO42-+Ba2+ BaSO4↓
![]() B.氯化铝溶液中加入过量氨水: Al3+ + 4NH3•H2O AlO2-
+ 4NH4+ +2H2O
B.氯化铝溶液中加入过量氨水: Al3+ + 4NH3•H2O AlO2-
+ 4NH4+ +2H2O
C.苯酚钠溶液中通入少量的二氧化碳:
![]() + CO2
+ H2O
+ HCO3—
+ CO2
+ H2O
+ HCO3—
![]() D.氯化亚铁溶液中通入氯气: Fe2++ Cl2
Fe3++2Cl-
D.氯化亚铁溶液中通入氯气: Fe2++ Cl2
Fe3++2Cl-
21.某有机物的结构简式可用下图表示。关于该物质的下列说法错误的是 ( )
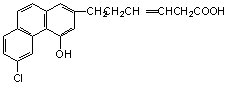
A.该物质具有酸性,且可以和3molBr2发生反应
B.该物质中含有多个苯环,且具有酚的结构
C.该物质可以和10molH2发生加成反应
D.该物质相对分子质量很大,属于高分子化合物
22.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(S.T.P),忽略反应过程中溶液得体积变化,则( ) A.反应过程中得到6.72L(S.T.P)的气体 B.最终得到7.8g的沉淀
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
第Ⅱ卷(共84分)
四、(本题共24分)
23.
(1)将上述元素周期表的外边框补充完整(目前已知道112种元素),并画出金属元素与非金属元素的分界线。
(2)形成化合物最多的元素的气态氢化物的电子式是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
24.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)2、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
![]() 25.在一定条件下,二氧化硫和氧气发生如下反应2SO2(g)+ O2 (g) 2SO3(g) + Q
(Q>0)
25.在一定条件下,二氧化硫和氧气发生如下反应2SO2(g)+ O2 (g) 2SO3(g) + Q
(Q>0)
(1)写出该反应的化学平衡常数表达式 K=
 (2)降低温度,该反应K值
,二氧化硫转化率 ,化学反应速度
(2)降低温度,该反应K值
,二氧化硫转化率 ,化学反应速度
(以上均填增大、减小或不变)
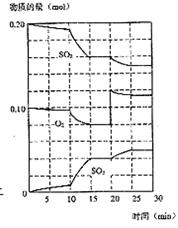
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____ ___________________。
(4)据图判断,反应进行至20min时,曲线发生变的原因是____________________________(用文字表达)10min到15min的曲线变化的原因可能是______________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
五、(本题共24分)
26.利用天然气合成氨的工艺流程示意如下:
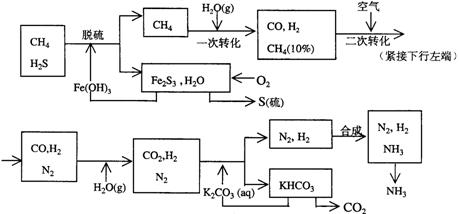
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
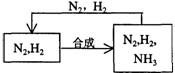
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
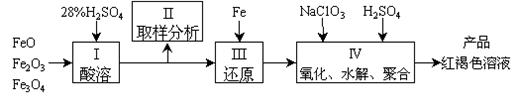
27. 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe3+。实验步骤如下:
|
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b)烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a)控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
六、(本题共20分)
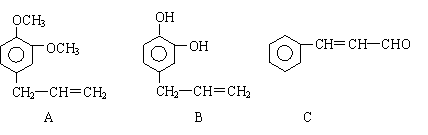 28.从某些植物树叶提取的挥发油中含有下列主要成分:
28.从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:
![]() 。
。
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式: 。
|
|
|
![]()
![]()
![]()
|
CH-COOH J |
|
|
![]() NaOH(aq)
NaOH(aq)
|
|
|
![]()
|
| |||||||||
|
| ||||||||
![]()
![]()
(1) 写出下列结构简式:A ;I 。
(2) D的同类别的同分异构体有 中(不包括D)。
(3) 写出E®H可能的反应条件 。
(4) 写出下列反应类型:
D ®B: ;
F ®C: 。
(5) 完成下列化学方程式:
E®C
‚C与足量D发生反应:
ƒ C与J反应成高分子化合物:
七、(本题共16分)
30.某铝土矿的主要成分为Al2O3×xH2O,还含有Fe2O3和SiO2杂质。称取17.50g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.30g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g。
(1) 该样品中,Fe2O3的物质的量为 。
(2) 试计算样品中Al2O3的质量。
‚试计算样品中Al2O3× xH2O的x值。
31.某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
2 Cu2S+3O2®2Cu2O+2 SO2 2Cu2O+Cu2S®6Cu+SO2
(1) 若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2) 若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
(3) 今将a mol Cu2S与b mol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来的温度,容器内的压强为P2,请完成下列表格:
| 反应后固体的成分 | Cu | Cu2S、Cu | Cu2O、Cu |
| b的取值范围 | |||
| P1与P2的关系(填>、<、=) | P1 P2 | P1 P2 | P1 P2 |
参考答案
一、(共10分)
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 | A | C | A | B | D |
二、(共36分)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | C | C | B | D | C | B | A | D | A | C | A | B |
三、(共20分。)
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 | AC | C | C | CD | BC |
四、(共24分)
23.(共8分)
(1)略(2)略(3)①填写镁、铝 ② 镁 b、c
24.(共8分)
(1)H2O2(2)H2CrO4 Cr(OH)3 (3)
(4)3.36L
25.(1)![]() (2)增大 增大 减小 (3)15-20 min和25-30 min
(2)增大 增大 减小 (3)15-20 min和25-30 min
(4)增加了O2的量 a b
五、(共24分)
26、(1)3H2S+2Fe(OH)3→Fe2S3+6H2O (2)27n (3)b
(4)生产纯碱(或其它合理,作制冷剂等,)
(5)
27、(1)b (2)a.c (3)利:原料成本较低 弊:产生气体对大气有污染
(4)a.c (5)Fe2O3、BaSO4 (6)a.e、d
28、(1)C11H14O2 (2)4 (3)(4)(5)略
29、略
七、(本题共16分)
30、(1)0.01mol (2) 10.2g ‚3
31、(1)60t (2) 27.048t
(3)
| 反应后固体的成分 | Cu | Cu2S、Cu | Cu2O、Cu |
| b的取值范围 | b=5a | 0<b<5a | 5a <b<7.5a |
| P1与P2的关系(填>、<、=) | P1 = P2 | P1 = P2 | P1 > P2 |
| |