高考化学模拟测试卷
化 学
本试卷分第1卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试用时120分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27
S-32 Cl-35.5 Cu—64 Li-7 Mg-24 Fe-56
第I卷 选择题 (共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.中共十六届六中全会审议了《中共中央关于构建社会主义和谐社会若干重大问题的决定》,其中人与自然和谐相处,是社会主义和谐社会的六个基本特征之一。对此,中央已明确提出建设资源节约型社会和环境友好型社会的战略任务,并将其列为“十一五”的重要目标。下列说法不符合人与自然和谐相处的是:
A.很多城市对废旧电池进行回收处理
B.许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理
C.现在不少地区正在使用沼气,太阳能,风能等能源替代传统的煤炭
D.许多地方政府出台相关法规来保护生物物种多样性
2.下列各种微粒的表示方法中,不正确的是
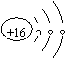 A.甲基的电子式:
B.次氯酸分子的结构式:H—O—Cl
A.甲基的电子式:
B.次氯酸分子的结构式:H—O—Cl
C.硫离子的结构示意图: D.碳-12的原子符号:12 6C
3.据悉,多哈亚运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生化学反应:5KClO3+6P=3P2O5十5KCl 。下列有关该反应的叙述中,正确的是
A.反应中红磷是氧化剂
B.发令时产生的白烟全是KCl固体
C.反应中消耗3 mol P时,转移电子的物质的量为15 mol
D.“火药”中的红磷可以用白磷代替
4.下列对实验仪器名称的标注或实验操作,正确的是
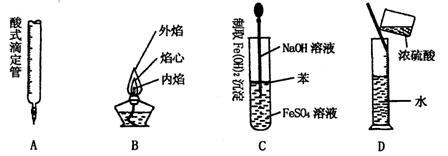
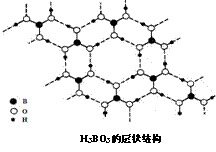 5.正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是
5.正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
6.下列说法中,正确的是
A.不可能有非金属单质置换出金属单质的置换反应
B.仅由非金属元素组成的化合物一定是共价化合物
C.能用同一通式表示的几种物质一定互为同系物
D.电能与化学能的相互转化过程中一定有新物质产生
7.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Na+ H+ Cl- NO3- B.K+ Ba+ OH- I-
C.Cu2+ Fe3+ Br- HCO3- D.Na+ Mg2+ Cl- SO42-
8.25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、
890.3 kJ/mol、2800 kJ/mol 。下列热化学方程式中,正确的是.
A.c(s)+1/2O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.设NA为阿伏加德罗常数,下列叙述合理的是: ( )
A.通常状况下,1molNaHCO3投入足量稀盐酸中,反应完后,可逸出NA个CO2分子
B.在含有1mol CH3COO-的醋酸钠溶液中, Na+数目略大于NA
C.46gNO2和N2O4混合气体中含有原子数为3NA
D.22.4L的O3分子所含原子数为3NA
10.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同。下列判断不正确的是
A.乙元素的族序数比甲元素的族序数大
B.甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲 < 丙
C.原子半径由大到小的顺序为丙>甲>乙
D.含乙元素的化合物数目比含甲、丙元素的化合物数目多
11.化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。
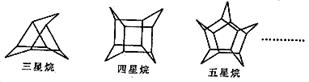 下列说法正确的是
下列说法正确的是
A.它们的一氯代物均只有三种
B.它们之间互为同系物
C.三星烷与乙苯互为同分异构体
D.六星烷的化学式为C18H24
12.下列叙述中不正确的是
A.在0.1 mol/L CH3COOH溶液中,c(H+)=c(CH3COO-)+c(OH-)
B.常温下将10 mL 0.02 mol/L NaOH溶液与l0 mL0.02 mol/L H2SO4溶液充分混合,
若混合后溶液的体积为20 mL,则混合后溶液的pH=2
C.在0.1 mol/L NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-)
D.在0.1 mol/L Na2CO3溶液中,2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-)
13.乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
C2H5OH+3O2=2CO2+3H2O,电池示意如图。下列说法中,正确的是
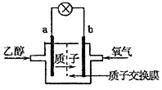 A.电池工作时,质子向电池的负极迁移
A.电池工作时,质子向电池的负极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是:
C2H5OH+3H2O+12e-=2CO2+12H+
D.b极上发生的电极反应是:4H++O2+4e-=2H2O
14.下列反应的离子方程式书写正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.向过氧化钠固体中滴加水:Na2O2+H2O =2Na++2OH-+O2↑
C.将溶质物质的量之比为4∶3的 NaHSO4和 Ba(OH)2两溶液混合:
4H++3SO42-+3Ba2++4OH-=3BaSO4↓+4H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:
Fe2++2H++H2O2=Fe3++2H2O
15.右图表示可逆反应A(s)+B(g) ![]() nC(g) ΔH=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是
nC(g) ΔH=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是
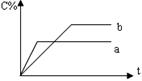 A.若条件为催化剂,则a表示有催化剂,b没有
A.若条件为催化剂,则a表示有催化剂,b没有
B.只控制温度,则a比b的温度高,ΔH>0
C.只控制压强,则a比b的压强大,n≥2
D.由图像可以作出判断,反应一定从正反应方向开始
16.两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2 Cr3++3I2+7H2O 。若向溶有2.83 gX的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
第Ⅱ卷 非选择题(共86分)
三、(本题包括2小题,共22分)
17. (8分) ①实验室可利用下图1所示装置来制取气体 (写出两种常见气体的化学式);②已知草酸(乙二酸)在受热时发生如下分解反应:H2C2O4 CO+CO2+H2O 。某同学拟用图1的改进装置图2来验证上述反应中有CO2和H2O生成。已知:草酸晶体的化学式为:H2C2O4·2H2O,熔点为100.1℃,分解温度约为170℃~180℃。试结合所学知识,分析该实验设计中的不足之处(至少指出3处)
。
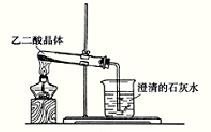
图1 图2
18.(14分) I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
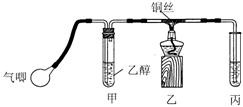 Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
⑴乙醇发生催化氧化的化学反应方程式为
 。
。
⑵实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ____;由于装置设计上的缺陷,实验进行时可能会 ____________
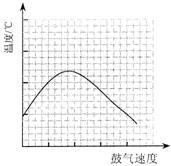
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因:
;你认为该实验中“鼓气速度”这一变量可用 来计量___________。
四、(本题包括2小题,共18分)
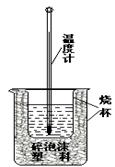
19、(10分)实验室利用如右图装置进行中和热的测定。
 回答下列问题:
回答下列问题:
①.该图中有两处未画出,它们是 、 ;
②.在操作正确的前提下提高中和热测定的准确性的关键是 ;
③.如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将 (填“偏大”、“偏小”、“不变”);原因是 。
20、(8分)有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液的实验如下:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中的上层清夜,加AgNO3 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
①.溶液中一定存在的离子是 ;溶液中肯定不存在的离子是:
②.为进一步确定其它离子,应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细步骤)
五、(本题包括1小题,共10分)
21.(10分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子。
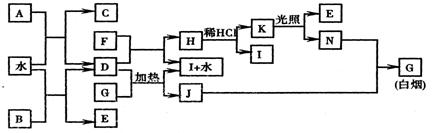
请按要求填空:
(1)B的电子式是 ,K的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)单质F与D的反应在工业上有重要的用途,其化学方程式是
。
六、(本题包括2小题,共18分)
![]() 22.(10分)已知:R—OH+HBr
22.(10分)已知:R—OH+HBr![]() R-Br+H2O,通过三步反应可以完成下列有机物间的转化:
R-Br+H2O,通过三步反应可以完成下列有机物间的转化:
(1)写出以上有机物转化过程中各步反应的化学方程式
第一步:
第二步:
第三步:
(2)写出CH2BrCHBrCH2Br的所有同分异构体的结构简式
23.(8分)有一种广泛应用于汽车、家电产品上的高分子涂料是按下列流程图生产的。
图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上
一氯取代位置有三种。
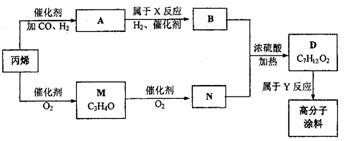
(1)试写出下列物质的结构简式:A M
(2)写出反应N+B![]() D的化学方程式:
D的化学方程式:
(3)写出反应类型:x ,Y
七、(本题包括2小题,共18分)
24.(8分能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
25.(10分)甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,
消耗的HNO3的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L
(不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是 mol。
为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是 mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。
参考答案:
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | B | A | C | C | D | D | D | C |
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 | BC | D | D | D | B | C | CD | C |
17.①O2、NH3、CH4等
② 试管口应向上倾斜大约45°,由于草酸晶体的熔点比其分解温度低,所以晶体在分解之前就已熔化流向试管口而无法继续实验;
石灰水变浑浊不一定是草酸晶体受热分解产生的CO2,也可能是乙二酸蒸气溶于石灰水形成的草酸钙沉淀;
不能证明草酸分解有水生成。因为使用的是草酸晶体,加热后,草酸晶体失去结晶水,即有水生成;
分解产生的CO直接排放到大气中,污染环境。(其它合理答案亦可)
18.Ⅰ.
⑴![]()
![]()
或![]()
![]()
⑵用pH试纸检测褪色后溶液的酸碱性。若酸性,则猜想①正确;反之,猜想②正确(或其它合理方法) 疑点 原溴水中的氢溴酸、次溴酸有没有参与反应,若无反应,溶液呈酸性的原因难以确定。
![]() Ⅱ.
Ⅱ.
⑴2CH3CH2OH+O2 2CH3CHO+2H2O
⑵使生成乙醇蒸气的速率加快且较均匀 发生倒吸
⑶过量的气体将体系中的热量带走 单位时间内甲中的气泡数(每空2分,共14分)
19、① 环形玻璃棒 烧杯上方的泡沫塑料盖(或硬纸板) ② 提高装置的保温效果 ③偏大 固体NaOH溶于水放热
20、(1)一定存在NO3-、SO42- Mg2+、Al3+;肯定不存在:Fe2+、HCO3-、I-、Ba2+;
(2)K+的检验可以用焰色反应;Cl-的检验:往溶液中加足量的硝酸钡溶液,过滤后,相滤液中加硝酸银溶液,再加稀硝酸,白色沉淀不溶解。
21. (1)
![]()
(2)![]()
(3)2Ca(OH)2 +2Cl2 =CaCl2 +Ca(ClO)2 +2H2O
24.(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ/mol(2分)
(2)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O (2分)
②96% (4分)
25.⑴Pb2O3+6HCl(浓)=2PbCl2+Cl2↑+3H2O(2分)
⑵根据题意:分解所得混合物中n(Pb2+)= ax mol、n(Pb4+)= a (1-x) mol
根据电子守恒:n(O2)= ax/2 mol、n(Cl2)=a (1-x) mol (2分)
y=n(O2)+n(Cl2)=ax/2 mol+a (1-x) mol=a (1-x/2) mol(2分)
⑶ Pb3O4、PbO 3:4(4分)
提示:
当分解产物为Pb2O3时,x=1/2;
当分解产物为Pb3O4时,x=2/3;
当分解产物为PbO时,x=1。
根据题意有:n(O2)/ n(Cl2)=5:3,即x=10/13
所以此时剩余固体包括Pb3O4、PbO两种物质,其物质的量之比为3:4。
注:答题中出现的其它合理答案均给分