2003年MAM高考化学仿真试题(三)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型(A、B)用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.下列各组物质中,都是由极性键构成为极性分子的一组是
A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl
2.我国城市环境中的大气污染物主要是
A.CO2、Cl2、N2、酸雨 B.SO2、NO2、CO、可吸入颗粒物
C.NH3、CO2、NO2、雾 D.HCl、SO2、N2、可吸入颗粒物
3.农用化肥和粪便的排放,会使地下水中含氮量增高,其中对人体有害的含氮污染物的主要存在形式是
A.NO![]() B.NO
B.NO![]() C.NH
C.NH![]() D.有机氮
D.有机氮
4.有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b;阴离子所带负电荷数c<d。则四种元素核电荷数由小到大排列正确的是
A.d<c<a<b B.c<d<b<a C.d<a<b<c D.c<d<a<b
5.欲除去镀在铝表面的铜镀层,可选用的试剂是
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠溶液
6.通过下列有关操作和现象,可以确定溶液中一定有Fe3+存在的是
A.加入足量铁粉后,溶液变成浅绿色
B.滴入KI溶液后,溶液呈棕黄色
C.滴入NaOH溶液后,析出的沉淀显白色逐渐变为灰绿色,最后变为红褐色
D.滴加KSCN溶液后,变为红色
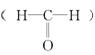 |
7.已知甲醛 分子中4个原子是共平面的,下列分子中所有原子不可能
同时存在于同一平面上的是
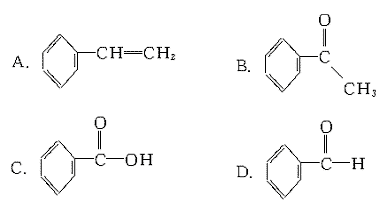
8.向倒扣在水槽中盛有NO的试管中缓慢通入35 mL O2,反应完成后,若试管内液面仍保持在原来的位置,则试管中原来的NO体积为
A.20 mL B.15 mL C.10 mL D.5 mL
二、选择题(本题包括10小题,每题5分,共50分;每小题有一至两个选项符合题意)
9.下列反应的离子方程式正确的是
A.碳酸钙溶于盐酸 CaCO3+2H+====Ca2++CO2↑+H2O
B.澄清石灰水中加入盐酸 Ca(OH)2+2H+====Ca2++2H2O
C.铜片加入稀硝酸中 Cu+NO![]() +4H+====Cu2++NO↑+2H2O
+4H+====Cu2++NO↑+2H2O
D.碳酸氢钠溶液中加入硫酸氢钠溶液中 HCO![]() +H+====CO2↑+H2O
+H+====CO2↑+H2O
10.设NA代表阿伏加德罗常数,下列说法中正确的是
A.NA个CO分子与NA个N2分子质量相等
B.20 g D2O含有电子数为10NA
C.25℃,1.01×105Pa时,NA个氢分子的体积约是22.4 L
D.同温同压下,相同体积的氟气和氩气所含的原子数相等
11.将甲、乙两种非金属的性质相比较,知道①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生氧化还原反应;③甲的最高价氧化物的水化物酸性比乙的最高价氧化物的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是
A.①④ B.③⑤ C.①②③ D.①②③④⑤
12.室温下,pH=12的氢氧化钠溶液和pH=8的氢氧化钠溶液等体积混合后,混合溶液中由水电离出的c(H+)为
A.5×10-8 mol·L-1 B.2×10-12 mol·L-1
C.5×10-3 mol·L-1 D.5×10-12 mol·L-1
13.顺利运输鱼苗,必须满足四个条件:①需要保持充足的氧气;②使鱼苗呼出的CO2气体及时排出;③防止细菌大量繁殖;④水溶液pH要调节在8~8.5。已知下列四种物质加入水中都可起到供氧作用(过氧化钙极微溶于水),在长距离储运鱼苗的水中,最好加入的是
A.过氧化钠 B.氯水 C.过氧化钙 D.双氧水
14.取pH=2的盐酸和醋酸各100 mL。分别稀释10倍后,再分别加入0.03 g Zn粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出H2多
B.盐酸与锌反应放出H2多
C.盐酸和醋酸分别与锌反应的速率一样
D.盐酸和醋酸分别与锌反应放出H2一样多
15.下列各组混合物不能用分液漏斗分离的是
A.硝基苯和水 B.苯和甲苯
C.溴苯和NaOH溶液 D.氯仿酒精
16.下列溶液中的各组离子,因发生氧化还原反应而不能大量共存的是
A.H+、Na+、NO![]() 、SO
、SO![]() B.AlO
B.AlO![]() 、OH-、Na+、NH
、OH-、Na+、NH![]()
C.Fe3+、SCN-、SO![]() 、Cl- D.Fe3+、HS-、Cl-、NH
、Cl- D.Fe3+、HS-、Cl-、NH![]()
17.用物质的量都是0.1 mol的HCN和NaCN配成1 L溶液,已知溶液中c(CN-)<c(Na+)>c(H+)>c(OH-),下列关系正确的是
A.c(Na+)>c(CN-)>c(H+)>c(OH-) B.c(CN-)+c(HCN)=0.2 mol·L-1
C.c(CN-)+c(OH-)=0.1 mol·L-1 D.c(Na+)+c(H+)=c(CN-)
18.向紫色Cr2(SO4)3溶液中,加入NaOH溶液至pH为4.6时,溶液中析出蓝灰色沉淀,
![]() 此时,溶液中存在着如下平衡关系:
此时,溶液中存在着如下平衡关系:
将上述溶液分成两等份,分装在a、b两试管中,向a试管中加入适量的NaOH溶液;向b试管中加入适量的H2SO4溶液。其颜色依次为
| A | B | C | D | |
| a试管中 | 紫色 | 蓝灰色 | 蓝色 | 绿色 |
| b试管中 | 绿色 | 绿色 | 紫色 | 紫色 |
第Ⅱ卷(非选择题 共76分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷中。(除题目有特殊规定外)
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 分 数 |
| 总 分 |
三、(本题共2小题,共23分)
19.(9分)实验室制取乙酸乙酯,有如下实验步骤:①向干燥的大试管中加入3 mL无水乙醇,2 mL浓硫酸,2 mL冰醋酸;②把仪器安装好,用酒精灯小心加热试管3~5分钟;③馏出成分用饱和碳酸钠溶液吸收;④将馏出物质和饱和碳酸钠溶液倒入分液漏斗中,进行分液即得到乙酸乙酯。请填写以下空白:
(1)步骤①加入浓硫酸的注意事项是 。
(2)在接收馏出成分的装置中,饱和碳酸钠溶液所起的作用是 。
(3)用分液漏斗分液时,将混合液体倒入分液漏斗后, 后,分出下层液体 (填“酯液”或“水液”)至 ,关闭分液漏斗的活塞。剩下的上层液体
出。(填“从上口倒出”或“从下口倒出”)
20.(14分)按如图装置和以下实验步骤,可以制取少量的溴苯和溴乙烷。①按图连接仪器装置,并检查装置的气密性;②气密性良好,再向烧瓶中加入少量苯和液溴,向锥形瓶中加入乙醇和浓硫酸混合液至恰好浸没导管C出口;③将A装置中的纯铁丝小心地向下插入液体中;④点燃B装置中的酒精灯,用小火缓缓地对锥形瓶加热10 min。据此填写和回答下列要求:
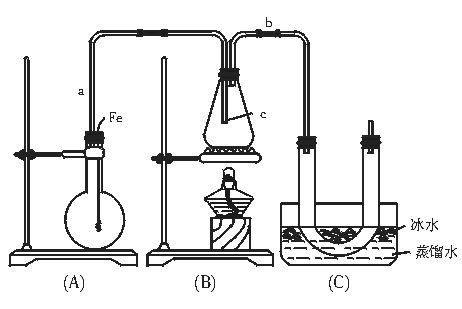
(1)写出本题制取溴苯和溴乙烷的两个化学方程式 、
。
(2)将铁丝小心地向下插入A烧瓶内液体中,观察到的现象是 。
(3)长导气管a的作用是 ,导管b的作用是 。
(4)U形管内用蒸馏水封住管底,其作用是 。
(5)反应完毕后,U型管内的现象是 ;分离出溴乙烷所用到的主要仪器的名称是 。
四、(本题包括2小题,共14分)
21.(8分)已知25℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因而pH增大。你认为上述解释中 (“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量的下列物质中的 (填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若 (填“甲”或“乙”)的解释正确,溶液的pH应 (填“增大”“减少”或“不变”)。
22.(6分)1998年Murad等三位教授因研究NO分子在人体内的独特功能而获诺贝尔奖。
(1)NO对环境的危害在于 。
A.破坏臭氧层 B.形成酸雨
C.高温下能使一些金属被氧化 D.与人体的血红蛋白结合
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性溶液中反应的离子方程式 。
(3)常温下把NO气体压缩到100个大气压,在一个体积固定的容器内加热到50℃,发现气体压强迅速下降,降至略小于原压强的![]() 就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。
就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。
五、(本题包括2小题,共23分)
23.(11分)据报道,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封同时服用,可以产生协同作用。
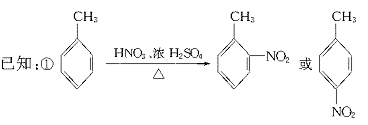
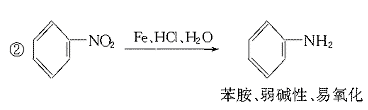
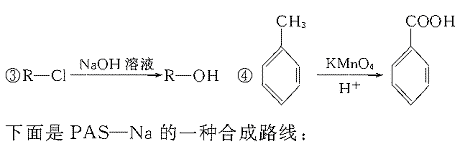
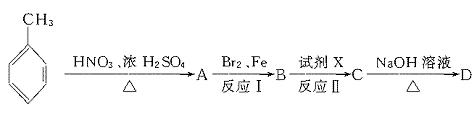
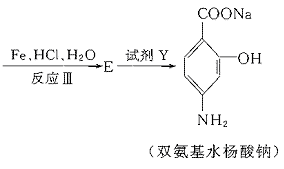
(1)写出下列反应的化学方程式:
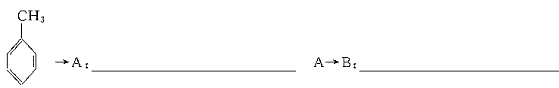
(2)写出下列物质的结构简式:C. ,D.
(3)指出反应类型:Ⅰ ,Ⅱ ,Ⅲ
24.(12分)1,4—丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制成,请写出序号物质的结构简式。
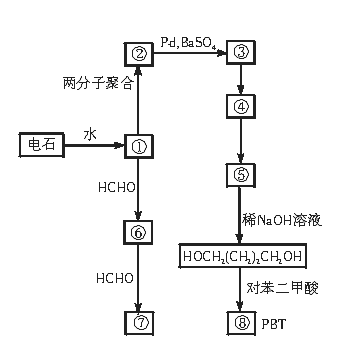
① ② ③ ④
⑤ ⑥ ⑦ ⑧
六、(本题包括2小题,共16分)
25.(8分)今有FeCl2、CuCl2混合溶液400 mL,经测定其中c(Cl-)为a mol·L-1,投入足量的锌粉b g,充分反应后过滤,所得固体残渣经洗涤干燥后,质量为c g,求原混合溶液中Fe2+、Cu2+的物质的量浓度。(只考虑金属与盐的完全反应)
26.(8分)为了预防碘缺乏病,国家规定每千克食盐中应含有40 mg~50 mg KIO3。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的KIO3,将溶液酸化并加入足量的KI淀粉溶液,溶液呈蓝色,再用0.030 mol·L-1的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO![]() +5I-+6H+====3I2+3H2O
+5I-+6H+====3I2+3H2O
I2+2S2O![]() ====2I-+S4O
====2I-+S4O![]()