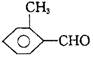
高考化学课前选择题练习(14)
2008年4月1日 编辑:熊维平
1.科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性
B.该粒子质量数为4
C.该粒子核电荷数为0
D.该粒子在周期表中与氢位于同一个位置
2.下列说法正确的是
A.同温同压下甲烷和氧气的密度之比为2:1
B.1g甲烷和1g氧气的原子数之比为 5:l
C.等物质的量的甲烷和氧气的质量之比为2:1
D.在标准状况下等质量的甲烷和氧气的体积之比为1:2
3.设NA为阿佛加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 L CO2和O2混合气体中含有的氧原子数约为2NA
B.常温常压下,0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
C.2 mol SO2和1 mol O2混合在(V2O5存在的条件下)密闭容器中加热反应后,容器内物质的分子数等于2NA
D.138克K2CO3晶体中的离子总数大于3NA
4.X、Y、Z和R为原子序数依次递增的四种元素。其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素。下列说法不正确的是
A.127R—的核外含有54个电子
B.Y、Z、R的氢化物的稳定性逐渐减弱
C.有lmolY的单质与水发生反应则转移电子的物质的量为2mol
D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色
5.下列有关实验的叙述中,正确的有
①蒸干AlCl3溶液可得纯净的无水氯化铝;②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;③无法用分液漏斗将甘油和水的混合液体分离;④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;⑥配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止。
A.③④⑥ B.①②⑤ C.③④⑤ D.②④⑥
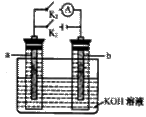 6.如右图所示,a、b是多孔石墨电极,某同学按图示装
6.如右图所示,a、b是多孔石墨电极,某同学按图示装
置进行如下实验:断开K2,闭合K1一段时间,观察
到两只玻璃管内都有气泡将电极包围,此时断开K1,
闭合K2,观察到电流计A的指针有偏转。下列说法不
正确的是
A.断开K2,闭合K1一段时间,溶液的pH要变大
B.断开K1,闭合K2时,b极上的电极反应式为: 2H++2e-= H2↑
C.断开K2,闭合K1时,a极上的电极反应式为:4OH-―4e-=O2↑十2H2O
D.断开K1,闭合K2时,OH-向b极移动
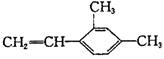
7.下列芳香族化合物中,其苯环上—氯代物有两种,1mol该化合物在一定条件下加氢时最多可消耗4mol氢气,则该化合物是
| |||
| |||
A. B.
| |||
| |||
C. D.
8.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
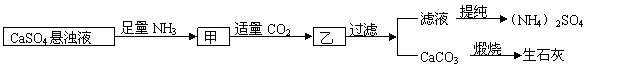 |
下列推断不合理的是
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.往甲中通CO2有利于(NH4)2SO4生成
9.室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
C.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足:
C(B+)>C(A-)>C(H+)>C(OH-)
 10.已知NO2和N2O4可以相互转化:2NO2(g)
10.已知NO2和N2O4可以相互转化:2NO2(g) ![]() N2O4(g);△H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是
N2O4(g);△H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是
A.a、b、c、d四个点中,只有b、d点
的化学反应处于平衡状态
B.前10 min内用υ(NO2)表示的化学反应
速率为0.06 mol/(L·min)
C.25 min时,导致平衡移动的原因是将
密闭容器的体积缩小为1L
D.图中的两条曲线,X是表示N2O4浓度
随时间的变化曲线
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 姓名 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|