高一化学竞赛考前训练(1)
(考试时间120分钟,满分150分)
| H 1.008 | 相对原子质量 | He 4.003 | |||||||||||||||
| Li 6.941 | Be 9.012 |
| B 10.81 | C 12.01 | N 14.01 | O 16.00 | F 19.00 | Ne 20.18 | |||||||||
| Na 22.99 | Mg 24.31 | Al 26.98 | Si 28.09 | P 30.97 | S 32.07 | Cl 35.45 | Ar 39.95 | ||||||||||
| K 39.10 | Ca 40.08 | Sc 44.96 | Ti 47.88 | V 50.94 | Cr 52.00 | Mn 54.94 | Fe 55.85 | Co 58.93 | Ni 58.69 | Cu 63.55 | Zn 65.39 | Ga 69.72 | Ge 72.61 | As 74.92 | Se 78.96 | Br 79.90 | Kr 83.80 |
| Rb 85.47 | Sr 87.62 | Y 88.91 | Zr 91.22 | Nb 92.91 | Mo 95.94 | Tc [98] | Ru 101.1 | Rh 102.9 | Pd 106.4 | Ag 107.9 | Cd 112.4 | In 114.8 | Sn 118.7 | Sb 121.8 | Te 127.6 | I 126.9 | Xe 131.3 |
| Cs 132.9 | Ba 137.3 | La-Lu | Hf 178.5 | Ta 180.9 | W 183.8 | Re 186.2 | Os 190.2 | Ir 192.2 | Pt 195.1 | Au 197.0 | Hg 200.6 | Tl 204.4 | Pb 207.2 | Bi 209.0 | Po [210] | At [210] | Rn [222] |
| Fr [223] | Ra [226] | Ac-Lr | Rf | Db | Sg | Bh | Hs | Mt |
| ||||||||
|
第Ⅰ题(10分)
A、B、C、D是短周期元素,A原子有两个电子层,其最高正氧化态与负氧化态代数和为零。B原子的最外层电子排布式为nsnnp2n。C、D两原子的最外层电子数分别是次外层电子数的一半,其中C为半导体材料。试写出:
1.画出B原子的轨道排布式 ;
2.A、B元素形成的酸酐的化学式 ;
3.D元素的单质与水反应的化学方程式 ;
4.写出B、C元素形成的化合物与强碱反应的离子方程式 ;
5.A、C元素气态氢化物的稳定性大小 < (用分子式表示)。
|
第Ⅱ题(8分)
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃下反应制得。
1.根据性质,推测氮化硅的用途是 。(填序号)
A.制汽轮机叶片 B.制有色玻璃 C.制光导纤维 D.作润滑材料
2.根据元素周期律知识,写出氮化硅的化学式 。
3.氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其它无机酸反应。试写出该陶瓷被氢氟酸腐蚀的化学方程式 。
4.现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,写出反应的化学方程式 。
|
第Ⅲ题(8分)
按下列要求写出相应反应的化学方程式。
1.久置的油画,白色部分(PbSO4)常会变黑(PbS),用双氧水搓擦后又恢复原貌。写出油画恢复原貌的化学方程式。
。
2.氯气通入淀粉碘化钾中,会看到淀粉变蓝,但通入过量氯气蓝色会消失,原因是氯气将生成的碘单质又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,写出蓝色消失反应的化学方程式。
。
3.浓硫酸与铜片共热时,反应后的溶液呈蓝色,同时有黑色沉淀物出现。有人认为黑色沉淀物是生成了氧化铜,实际上这种黑色沉淀并不是氧化铜。写出生成黑色沉淀物的化学方程式。
。
4.某学生在做化学实验时,不慎被双氧水烧伤,皮肤颜色变白,疼痛难忍,教师用少量稀高锰酸钾溶液涂抹在烧伤处,结果有黑色固体生成,疼痛感觉立即消失,用水清洗皮肤后,皮肤颜色复原。写出有关反应的化学方程式。
。
|
第Ⅳ题(8分)
请应用原子核外电子的排布规律和元素周期律的有关知识回答下列问题。
1.最近在稳定岛理论的驱动下,合成了第114、116、118号元素。请写出116号元素的价电子构型: ;它在元素周期表中的位置是 。
2.电子构型为[Xe]4f145d56s2的元素是 。
A.稀有气体 B.过渡元素 C.主族元素 D.稀土元素
3.某元素的基态原子最外层为5s2,最高氧化态为 +4,它位于周期表的 区,其+2氧化态离子的电子构型为 ,其最高氧化态氧化物的化学式为 。
4.我们已经知道描述核外电子运动状态的一些电子亚层符号,如s、p、d、f等,如果接下来的亚层符号为g,则第一个包含g亚层电子的元素的原子序数为 。
5.假设我们的世界从三维变为二维,则改变后的元素周期表第2周期有 种元素。
|
第Ⅴ题(6分)
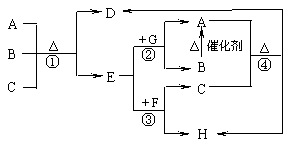 下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。
下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。
请回答下列问题:
1.写出D的化学式 。
2.写出反应③的离子方程式 。
3.在反应①中每生成1molE,转移电子数为 mol。
|
第Ⅵ题(14分)
按要求回答下列各题。
1.写出下列物质的结构式。
POCl3: HOCN:
2.用价层电子对互斥模型预测SO2Cl2、ICl4—的立体结构,并给出中心原子的氧化数和杂化轨道类型。
| 粒子 | 立体结构 | 中心原子 氧化数 | 中心原子 杂化轨道类型 |
| SO2Cl2 |
|
|
|
| ICl4— |
|
|
|
3.写出下列粒子中的Π键类型。(例如CO2:2Π4 )
O3: SO3:
|
第Ⅶ题(12分)
在无氧的条件下以干燥的钠汞齐(以Na—Hg表示)和干燥的二氧化硫一起振荡,只制得固态化合物A。已知A中钠元素的质量分数为26.41%,氧元素的质量分数为36.76%,其余为S元素。
1.试确定A的化学式并命名A。写出生成A的化学反应方程式。
2.若在有氧的条件下,进行上述反应,会有什么样的结果?说明A具有什么样的化学性质?
3.若将A加热到402K时,质量减轻了18.39%。分析得到的固体残渣,发现是两种物质(记为B和C)组成的混合物。试写出A分解的化学反应方程式。
|
第Ⅷ题(8分)
将固体CaC2O4·H2O放在一个可称量的容器中加热灼烧,固体质量随温度的升高而变化,测得数据如下:
| 温度/℃ | 25 | 325 | 700 | 1160 |
| 固体质量/g | 1.000 | 0.877 | 0.685 | 0.384 |
根据计算推理,完成下列填空:
1.写出325℃ 和700℃时固体产物的化学式: 、 。
2.写出325℃ ~ 700℃时发生的化学反应方程式: 。
3.计算出1160℃时,反应所得产物的摩尔质量: 。
|
第Ⅸ题(16分)
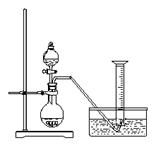
某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况)。
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品过氧化钠的质量。
实验步骤:
① 称取过氧化钠固体2.00 g ;
② 把这些过氧化钠放入气密性良好的气体发生装置中;
③ 向过氧化钠中滴入水,用量筒排水集气,量筒内液
面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容。
请回答下列问题:
1.有1 000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒,理由是 。
2.生成气体体积是 mL, 为保证生成气体体积的准确性读取量筒刻度时应注意的问题是 。
3.据研究,与上述反应同时发生的反应还有 : Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (偏高或偏小)。
4.为校正实验结果,该学生补做了如下实验:用移液管移取20.00 mL容量瓶中的液体,放入锥形瓶中,用0.0100 mol/L的KMnO4溶液去测定,至溶液中刚好出现浅浅的紫红色,停止滴定,用去了24.00 mLKMnO4溶液。反应式:2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2↑ + 8H2O,该实验应选用 式滴定管。
5.通过以上数据计算,该过氧化钠的纯度为 。
6.如何避免因为生成H2O2造成的误差? 。
|
第Ⅹ题(10分)
某科研小组欲测定一种溶液中某微量的IO3-的浓度,采用“化学放大”的方法。取1L 含IO3-的该溶液和足量的KI溶液混合,加入一定量的H2SO4,使IO3-均转化为I2。用CCl4萃取I2(萃取率为100%),然后再用肼的水溶液将I2反萃取至水相(N2H4 + 2I2 = 4I-+ N2 + 4H+),再用过量的Br2氧化,除去剩余的Br2后加入过量的KI,加H2SO4酸化,此时被Br2氧化后所得的IO3-又与I-结合生成I2。用淀粉做指示剂,用Na2S2O3标准溶液(c = 0.100 mol·L-1)滴定,消耗Na2S2O3 20.06 mL。试计算原溶液中IO3-的浓度。
参考答案第Ⅰ题(每空2分,共10分)
![]() 1.
2.CO2 3.2Li+2H2O =2LiOH +H2↑ 4.SiO2 + 2OH- = SiO32- +H2O
5.SiH4< CH4
1.
2.CO2 3.2Li+2H2O =2LiOH +H2↑ 4.SiO2 + 2OH- = SiO32- +H2O
5.SiH4< CH4
第Ⅱ题(8分) 1.A(2分) 2.Si3N4(2分)
![]() 3.Si3N4 +
12HF = 3SiF4↑+ 4NH3↑(2分) 4.3SiCl4 + 2N2 + 6H2 Si3N4 +12HCl(2分)
3.Si3N4 +
12HF = 3SiF4↑+ 4NH3↑(2分) 4.3SiCl4 + 2N2 + 6H2 Si3N4 +12HCl(2分)
第Ⅲ题(8分)1.PbS + 4H2O2 = PbSO4 + 4H2O(2分) 2.5Cl2+ I2 + 6H2O = 2HIO3 +10HCl(2分)
![]() 3.4Cu + 4H2SO4 3CuSO4 +CuS↓+ 4H2O
3.4Cu + 4H2SO4 3CuSO4 +CuS↓+ 4H2O ![]() 或5Cu + 4H2SO4 3CuSO4 +Cu2S↓+4H2O(2分)
或5Cu + 4H2SO4 3CuSO4 +Cu2S↓+4H2O(2分)
4.2KMnO4 + 3H2O2 = 2MnO2 + 2KOH + 3O2↑+2H2O(2分)
第Ⅳ题(共8分,每空1分)1.7s27p4 第7周期ⅥA族 2.B
3.d [Kr]4d2 ZrO2 4.121 5.6
第Ⅴ题(6分)
1.K2SO4(2分) 2.SO2 +Cl2 +2H2O = 4H+ + SO42- + 2Cl-(2分) 3.(2分)
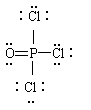 第Ⅵ题(14分)
第Ⅵ题(14分)
![]() 1.
(2分)
(2分)
1.
(2分)
(2分)
2.(每空1分)
| 粒子 | 立体结构 | 中心原子 氧化数 | 中心原子 杂化轨道类型 |
| SO2Cl2 | 四面体型 | +6 | sp3 |
| ICl4— | 平面正方形 | +3 | sp3d2 |
3.Π4 (2分) Π6 (2分)
第Ⅶ题(12分)
1.A:Na2S2O4(2分);连二亚硫酸钠(2分);
2SO2+2Na-Hg = Na2S2O4+2Hg(2分)
2.有O2存在时,A会被氧化(得到Na2S2O6或NaHSO3)(2分);说明Na2S2O4具有强还原性。(2分)
3.2Na2S2O4 = Na2S2O3+Na2SO3+SO2↑(2分)
![]() 第Ⅷ题(每空2分,共8分)
第Ⅷ题(每空2分,共8分)
1.CaC2O4 、CaCO3 2.CaC2O4 CaCO3+CO↑ 3.56.11 g·mol-1
第Ⅸ题(每空2分,共16分)
1.500 mL 2÷77.98×11.2=0.287 L时,所测量体积尽可能接近仪器的最大量程
2.56 mL 使量筒内外液面持平 3.偏低
4.酸式滴定管 5.48.74 %
6.在过氧化钠与水反应之前加少量的二氧化锰
第Ⅹ题(10分)
2Na2S2O3 + I2 = Na2S4O6 + 2NaI(2分)
与Na2S2O3反应的I2的物质的量为:
n(I2)=×20.06×10—3×0.100 = 1.003×10—3(mol)(3分)
5KI +KIO3 +3H2SO4 = 3K2SO4 + 3I2 + 3H2O(2分)
原溶液中的浓度为:
c(IO3—)=×1.003×10—3÷1=5.57 ×10—5 (mol·L—1)(3分)