高一化学第一学期六校联考试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分,考试时间90分钟。
注意事项:
1、 答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的学校、班级、姓名和考号填写在答卷上
2、 选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案;不能答在试卷上。
3、 非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答卷各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4、 考生必须保持答卷的整洁,考试结束后,将答题卡交回。
本卷可能用到的相对原子质量:H-1 N-14 O-16 Na-23 Mg-24 Al-27 Cu-64 Y-88.9 Ba-137
第I卷(选择题 80分)
一、选择题(每小题4分,共40分。每小题只有一个选项符合题意。)
1.下列几种计量仪器①托盘天平②量筒③容量瓶④滴定管⑤温度计。其中无零刻度的是
A.②③ B.只有②
C.①⑤ D.①②③⑤
2.下列物质露置于空气中,能发生氧化还原反应的是
A.Na2 O B.NaOH C.Na2CO3 D.Na2O2
3.下列物品和设备所用材料为硅酸盐的是
①陶瓷餐具;②门窗玻璃;③水晶镜片;④石英钟表;⑤光导纤维;⑥计算机芯片
A. ②④⑤ B. ①⑤
C. ①② D. ③④⑥
4.欲观察氢气燃烧的焰色,燃气导管口的材料最好是
A.钠玻璃 B.钾玻璃 C.石英玻璃 D.铜管
5.吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是
A.氧化剂 B. 还原剂
C.既是氧化剂又是还原剂 D. 既不是氧化剂,又不是还原剂
6.为了除去粗盐中的Ca2+ 、SO42- 及泥沙,可将粗盐溶于水,然后进行下列操作:①过滤;②加适量的盐酸;③加过量的Na2CO3溶液;④加过量BaCl2溶液,正确的操作顺序是
A.① ③ ④ ② B. ③ ① ④ ②
C.① ② ③ ④ D. ④ ③ ① ②
7.往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
A.颜色变浅 B.变为深绿色 C.没有改变 D.变棕黄色
8.青铜是我国使用最早的合金,青铜是:
A. 铜硅合金 B. 铜锡铅合金
C. 铜铝合金 D. 表面生成铜绿的纯铜
9.如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当打开止水夹K,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是
| 编 号 | ① | ② | ③ |
| A中气体 | H2 | NH3 | NO |
| B中气体 | Cl2 | HCl | O2 |
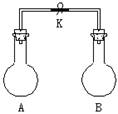
A. ②③① B. ③①② C. ③②① D. ①②③
10.以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是
A.0.50、0.50、0.50 B.0.50、1.0、1.5
C.0.25、1.0、1.5 D.1.0、0.25、0.17
二、选择题(每题有一个或两个正确的选项,每题4分,若正确选项有两个时,漏选一个扣2分,多选、错选得0分,共40分)
11.下列实验操作时,一般情况下不应该相互接触的是
A.用胶头滴管向试管滴液体时,滴管尖端与试管内壁
B.向容量瓶中注入溶液时,移液用的玻棒与容量瓶颈内壁
C.用移液管向锥形瓶内注液时,移液管的尖嘴与锥形瓶内壁
D.实验室将气体HCl溶于水时,将倒置的漏斗口与水面
12.下列说法中正确的是(![]() 表示阿伏加德罗常数)
表示阿伏加德罗常数)
A.28 g氮气含有的原子数目为![]()
B.2.3 g金属钠变成钠离子时失去的电子数目为0.1![]()
C.1 mol水的质量与![]() 个水分子的质量之和相等
个水分子的质量之和相等
D.在相同状况下,22.4 L氧气与氮气的混合物所含分子数都为![]()
13.在某无色透明的酸性溶液中,大量存在的离子组是
A.Na+ 、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3-
C.Na+、K+、Cl-、NO3- D.Fe3+、K+、SO42-、Cl-
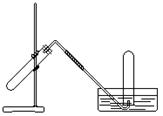 14.右图装置可用于
14.右图装置可用于
A. 加热NaHCO3制CO2
B. 用Cu与稀HNO3反应制NO
![]() C. 用NH4Cl与浓NaOH溶液反应制NH3
C. 用NH4Cl与浓NaOH溶液反应制NH3
D. 加热氯酸钾和少量二氧化锰制O2 水
15.碱石灰、P2O5和CaCl2(固)都有干燥作用,根据物质的性质和用途可归为一类。从以下选项中选出能与这三种物质归为一类的物质应该是
A. 浓H2SO4 B. 浓HNO3 C. NaHCO3 D. 硅胶
16.四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水糟中,发生的现象如下图所示,其中充满Cl2的试管是
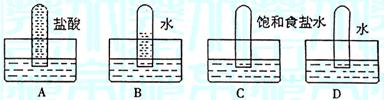
17.下列离子方程式书写正确的是
A.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
B.金属铝溶于盐酸中 2Al + 6H+ = 2Al3+ + 3H2↑
C.铜与浓硝酸反应 Cu+2H++2NO![]() = Cu2++2NO↑+H2O
= Cu2++2NO↑+H2O
D.H2SO4溶液与过量的Ba(OH)2反应 Ba2++SO42-+2H++2OH- = BaSO4↓+2H2O
18.下列叙述正确的是
A. 同温同压下,相同体积的物质,它们的物质的量必相等
B. 任何条件下,等质量的氮气和一氧化碳所含的分子数必相等
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 等体积、等物质的量浓度的强酸中所含的H+ 数一定相等
19.下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.Na2O2和CO2 C.NaOH和Al(OH)3 D.C 和O2
20.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。要在家庭将它们区分开来,下面的方法中可行的是
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
D.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
第II卷(非选择题 共70分)
三、(本题包括2小题,共33分。)
21.(23分)
(1)铁是人体必需的微量元素,目前市售补铁制品较多,为保护消费者的利益,质检部门需对补铁剂中铁的含量进一步测定。
①将补铁剂中的Fe2+氧化成Fe3+,结合你所选的氧化剂写出相关的反应式:
_________________________________________________________________________
②将Fe3+用氨水沉淀为不溶于水的氢氧化铁,试写出发生反应的离子方程式:
_________________________________________________________________________
③举出一种检验Fe3+的化学试剂(所选试剂不能是碱类物质)和相关的实验现象
(2)生铁是一种铁合金,下面的实验可以粗略测定生铁样品的含碳量。把生铁高温灼烧,生铁中的碳和硫转化成CO2和SO2(SO2可以被KMnO4溶液吸收)气体,将气体通入下列装置:
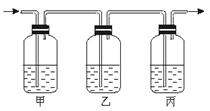
装置中盛放的溶液可从下列4种试剂中选择(每种试剂只能用一次)
①澄清石灰水 ②KMnO4 ③品红 ④浓H2SO4
那么,根据实验的需要,甲、乙、丙三个瓶盛的试剂依次最好是(填编号) 。
(3)若将水蒸气通入高温的还原铁粉,发生反应的化学方程式是:
(4)SO2是一种大气污染物,向大气中过量排放SO2将会形成酸雨污染。正常雨水pH约为_________。(选“5.6”“7.0”或“8.4”)。 为了防止污染,工厂收集排出的SO2并与空气反应合成三氧化硫(写出反应的化学方程式) 。三氧化硫通入浓氨水,可得到一种肥料(写出反应的化学的方程式)
。
22.(10分)臭氧层因为能吸收太阳光中的紫外线而成为人类和生物的保护伞,但因为其很强的氧化性,如果在人类生活空间的大气中臭氧的体积分数大于10-5%时,对人体和动植物造成危害。某中学化学课外活动小组,想验证臭氧的氧化性强于氧气,通过资料收集和互联网查询最后筛选并设计实验原理和步骤:
(1)实验的反应原理:2KI+O3+H2O=2KOH+I2+O2 淀粉溶液遇单质碘变蓝色
(2)实验用品:臭氧消毒碗柜、 a 溶液、碘化钾溶液、滤纸、玻璃片、温度计。
(3)实验步骤:
①取a溶液与碘化钾溶液混和;
②取两片用滤纸剪成的纸条,在a溶液和碘化钾溶液的混和液中湿润后分别置于两块洁净的玻璃片上(命名为玻璃甲和乙);
③将玻璃片甲置于臭氧消毒碗柜中并接通电源生成臭氧。另玻璃片乙置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等。
④观察现象并进行记录:
| 时间(分钟) | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 观察到滤纸的颜色变化 | 玻璃甲上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃乙上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
请根据如上实验的原理、步骤及你所学的知识回答下列问题:
(1)实验药品中的a溶液是 溶液。
(2)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是什么?
。
(3)写出在臭氧消毒柜中O2转化成O3的化学方程式 。
(4)从实验数据记录可以得出的结论是 (填序号)。
A、O3的氧化性比氧气强;
B、氧气也能氧化碘化钾中的碘离子;
C、空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的;
D、O3不仅氧化I—的速率比氧气快,而且有漂白作用。
四、(本题包括2小题,共25分。)
23.(13分)我们生活中的许多现象及大量物质的应用都与氧化还原反应有关。请运用氧化还原反应的知识回答下列问题:
(1)氯气与水反应生成的次氯酸(HClO)具有杀菌作用,常用于自来水的消毒。在次氯酸中,氯元素的化合价为 ,氯原子容易得到电子,从而使氯元素的化合价降低,因此次氯酸具有强 。
(2)实际生活中,常将漂白粉用于消毒,请写出工业上制取漂白粉的反应方程式:
(3)漂白粉在空气中长期露置会失效,原因是:(用方程式表示)
(4)自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单质硅、氧气等。如果要把某元素由化合态变成单质,则它 (填序号)。
A. 被氧化 B. 被还原
C. 有可能被氧化,也有可能被还原 D. 由高价态变为零价
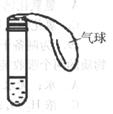 24.(12分)如右图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体倒入液体A中,观察到有无色气泡产生,且气球涨大。
24.(12分)如右图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体倒入液体A中,观察到有无色气泡产生,且气球涨大。
(1)若A中液体能使pH试纸显红色,则B可能是 ;
反应的化学方程式是 。
(2)若A中液体能使pH试纸显蓝色,则B可能是 ;
反应的化学方程式是 。
(3)若A中液体使pH试纸颜色无明显变化,则B可能是 ;
反应的化学方程式是 。
 五、(本题包括1小题,共12分。)
五、(本题包括1小题,共12分。)
25.在含镁离子、铝离子的无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示。 由此确定:
(1)原无色溶液除Mg2+、Al3+外还含有的阳离子是 。
(2)原溶液中Mg2+、Al3+的物质的量之比为 。
(3)已知所加的氢氧化钠溶液的质量分数为14%(密度为1.15g/cm3),若要配制500毫升该氢氧化钠溶液,需要多少克氢氧化钠?配得溶液的物质的量浓度是多少?
高一化学答案
一、二、选择题(1~10小题为单项选择,每题4分,共40分;11~20题每小题有一个或两个答案,当答案为两个选项时,漏选一个得2分,但只要错选一个,该小题得0分,每小题4分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 选项 | A | D | C | C | B | D | D | B | A | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 选项 | A | BC | C | B | AD | C | BD | B | B | C |
三、(本题包括2小题,共33分)
21.(23分)
(1)①2Fe3+ + Cl2 = 2Fe2+ + 2Cl- (3分,合理就给分)
②Fe3+ + 3NH3·H2O = Fe(OH)3 + 3NH4+ (3分)
③滴加KSCN溶液到待测液,若出现血红色就说明有2Fe3+ (3分)
![]() (2)②③①
(3分)
(2)②③①
(3分)
(3) 3Fe + 4H2O = Fe3O4 + 4H2↑ (3分)
(4) 5.6 (2分) 2SO2 + O2 = 2SO3 (3分) SO3 + NH3·H2O (3分)
22.(10分)
(1) 淀粉 (2分)
(2) 温度会影响反应的速度,保持温度相同是为了减少误差 (2分)
![]()
(3) 3O2 = 2O3 (3分)
(4) A B D (3分,漏一个扣1分,错选得0分)
四、(本题包括2小题,共25分)
23.(13分)
(1)+1 (2分) 氧化性 (2分)
(2) 2Ca(OH)2 + 2Cl2 = 2 CaCl2 + Ca(ClO)2 + 2H2O (3分)
(3) Ca(ClO)2 + H2O +CO2 = CaCO3 + 2HCl + O2↑(3分)
(4) C (3分)
24.(12分)
(1) Zn Zn + 2H+ = Zn2+ + H2↑ (前后各2分,共4分。合理就给分)
(2) Al 2Al +2NaOH +2H2O = 2NaAlO2 +3H2↑(前后各2分,共4分)
![]()
(3) MnO2 2H2O2 = 2H2O + O2↑ (前后各2分,共4分)
五、(本题包括1小题,共12分)
25.(12分)
(1) H+ (3分)
(2) 1 :2 (3分)
(3)解:设需要氢氧化钠的质量为X
X
![]() =
14%
(2分)
=
14%
(2分)
500ml ×1.15g/cm3
X = 80.5g (1分)
设溶液的物质的量浓度为C(NaOH)
n(NaOH) m(NaOH) ÷M(NaOH)
![]()
![]() C(NaOH) =
=
C(NaOH) =
=
V V
80.5g÷40g/mol
![]() =
= 4.02mol/L (3分)
=
= 4.02mol/L (3分)
0.5L
答:需要氢氧化钠80.5克,配得溶液的物质的量浓度为4.02摩尔/升。