高一年级化学硫及其化合物单元测验
学号-----------------------------------------姓名--------------------------------------------
答题所需要的相对原子质量:Cu:64,S:32,O:16,H:1,Fe:56,Na:23,
一、选择题(本题只有一个正确的选项,请将正确选项的序号填在答题卷上。每题3分)
1.下列污染现象主要与SO2有关的是 ( )
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
2. .有关亚硫酸的下列叙述中,不正确的是 ( )
A.亚硫酸是SO2的水溶液,显酸性
B.亚硫酸不稳定,容易分解为水和SO2
C.亚硫酸具有漂白性,能够使品红溶液褪色
D.亚硫酸对人体有害,所以用SO2漂白过的食品不能食用
3. 全社会都在倡导诚信,然而总是有一部分不法商贩却在背道而驰。如有些商贩为了使银
耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩所制取的银耳是利用
A.S的漂白性 B.S的还原性 C.SO2的漂白性 D.SO2的还原性
4. 检验下列离子时,选用的试剂错误的是
A.Fe2+ (KSCN溶液) B.Cl- (稀硝酸酸化的AgNO3溶液)
C. NH4+ (NaOH溶液) D.SO42- (先加盐酸后加BaCl2溶液)
5. 下列关于浓硫酸的叙述中,正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
 D.浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化
D.浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化
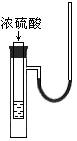
6. 右图小试管中盛有几毫升水,与大试管连通的U型细玻璃管内放有少量水(已染成红色)。如沿小试管壁小心地慢慢注入3 mL浓硫酸,静置片刻后,U型细玻璃管中可观察到的液面现象是
A. 左高右低 B. 左低右高
C. 左右一样高 D. 来回振动
7.酸雨给人类带来了种种灾祸,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是
①对燃煤进行脱硫;②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中;③人工收集雷电作用所产生的氮的氧化物;④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等。
A.①②③④ B.①②③ C.①②④ D.①③④
8.飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的作用可能是:
A.氧化剂 B.还原剂 C.催化剂 D.载体
9.下列变化中,不属于化学变化的是
 A.氯水使有色布条褪色 B.SO2使品红溶液褪色
A.氯水使有色布条褪色 B.SO2使品红溶液褪色
C.活性炭使红墨水腿色 D.O3 (有强氧化性)使某些染料腿色
10.右图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是 A.N2 B. H2 C. CO D.SO2
11.有人做过粗略统计,家用小气车和公交车消耗燃料之比为2:5,它们排放含污染 物的尾气量之比也约为2:5。如果家用小气车平均乘做2人,公交车平均栽客50人, 则乘家用小气车每人排放的尾气是乘公交车每人排放尾气的
A.1倍 B.10倍 C.100倍 D.无法确定
12.下列反应的离子方程式不正确的是
A.金属钠与饱和食盐水:Na+2H2O====Na++2OH-+H2↑
B.小苏打与烧碱溶液:HCO![]() +OH-====CO
+OH-====CO![]() +H2O
+H2O
C.碳酸氢钠与足量石灰水:HCO![]() +Ca2++OH-=====CaCO3↓+H2O
+Ca2++OH-=====CaCO3↓+H2O
D.用氨水吸收少量SO2:2NH3·H2O+SO2====2NH![]() +SO
+SO![]() +H2O
+H2O
13.根据反应:2H2S + O2 = 2S↓+ 2H2O;4NaI + O2 + 2H2SO4 = 2l2 + 2Na2SO4 + 2H2O;
Na2S + I2 = 2Nal + S↓,判断下列物质的氧化性强弱,正确的是 ( )
A.O2 > I2 >S B.H2S > NaI > H2O
C.S > I2 > O2 D.H2O > Nal > H2S
14.浓硫酸与下列物质反应时,既表现强酸性又表现强氧化性的是
A、赤热的木炭 B、蔗糖遇浓硫酸变黑并膨胀 C、亚硫酸钠 D、铜片
15.50 mL 18 mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是
A.等于0.9 mol B.大于0.45 mol,小于0.9 mol
C.等于0.45 mol D.小于0.45 mol
16.把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为2︰1,则原混合物中Fe2O3与Fe的物质的量之比为
A.1︰1 B.2︰5 C.4︰1 D.3︰1
17.(每空3分) 利用右图装置,写出除去下列气体中的杂质的方法,并写出化学
方程式(括号内的气体为杂质)。
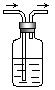 (1)CO2(SO2)
,
(1)CO2(SO2)
,
化学方程式 。
(2)SO2(SO3,假设SO3为气体) ,
化学方程式 。
18.(每空3分)下图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图。往试管Ⅰ中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管Ⅱ的溶液中。
(1)Ⅰ管中发生反应的化学方程式为:——————————————————————————————
(2)若试管Ⅱ中的溶液是石蕊试液,反应一段时间后,试管Ⅱ中看到的现象是______________________________,表明生成的SO2气体水溶液具有_____性,SO2与水反应的化学方程式为:___________________________________。
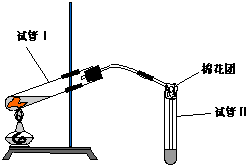 (3)若试管Ⅱ中的溶液是品红试液,反应一段时间后,看到的现象是_____________________,说明SO2具有________性。反应充分后,取下试管Ⅱ并在酒精灯上加热,看到的现象是_______________________________
(3)若试管Ⅱ中的溶液是品红试液,反应一段时间后,看到的现象是_____________________,说明SO2具有________性。反应充分后,取下试管Ⅱ并在酒精灯上加热,看到的现象是_______________________________
(4)实验过程中,试管Ⅱ管口塞一团浸有NaOH溶液的棉花,作用是__________________,有关反应的离子方程式为:____________________________________________________。
19.(13分)二氧化硫是一种酸性氧化物,在与烧碱发生反应时因二氧化硫和烧碱物质的量比的不同,产物不同。请写出下列条件下反应的化学方程式:
二氧化硫与足量的烧碱反应的化学方程式为:————————————————————
过量的二氧化硫与烧碱反应的化学方程式为:————————————————————————————————
某工厂每天烟筒排放2.0 * 104 m3 (标准状况)尾气,其中含0.112%(体积分数)的 SO2 ,现欲用2.0mol•L-1 氢氧化钠溶液进行处理,每天至少需要氢氧化钠溶液多少升?
硫及其化合物单元测验答案
学号-----------------------------------------姓名--------------------------------------------
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 选项 | B | A | C | A | D | B | C | C | C | D | B | A | A | D | D | B |
17.
(1)用饱和碳酸氢钠或饱和亚硫酸氢钠溶液洗气
SO2+2NaHCO3= Na2SO3+2CO2+H2O 。
(2)用浓硫酸洗气
SO3+H2SO4=H2S2O7 。
18.
(1)—Cu+2H2SO4 = CuSO4 + SO2 +2H2O
(2)变红,酸
SO2 + H2O ≒ H2SO3
(3)褪色,漂白,红色复现
(4)吸收尾气
SO2+2OH- = SO32- + H2O
19.:
SO2+NOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
答:每天至少需要氢氧化钠溶液500L