高一年级化学秋季期中联考试题
高一年级化学试题
命题学校:华科大附中 命题人:贺文风 审题人:李渭西
本试卷分第I卷(选择题)、第II卷(非选择题)两部分,共6页。满分l10分,考试用时
90分钟。
1、答题前,考生务必将自己的学校、姓名、考号填写在试卷指定位置。
2、将第I卷答案写在选择题答案栏内,将第II卷答案写在各题指定答题处。
可能用到的相对原子质量:H1 C12 N14 016 Na 23 K 39 Li 7
第I卷(选择题,共54分)
本卷包括18小题,每小题3分,共54分。每小题只有一个选项符合题意。
1.化学研究的对象是各种各样的物质。下列说法中不正确的是
A.原子分子学说的建立是近代化学发展的里程碑
B.我国科学家于1965年在世界上第一次用化学方法合成了具有生物活性的蛋白质
C.按化学组成,可将材料分为非金属材料、金属材料、有机高分子材料
D.利用太阳能使C02、H20、N2等燃烧产物重新组合而变成CH4、CH30H、NH3等燃料的设想是不可能实现的
2.下列物质所属的类别正确的是
A.醋酸:一元强酸 B.NaHSO4:酸式盐
C.Na2O2:共价化合物 D.C02:弱电解质
3.关于煤、石油、天然气等资源的说法正确的是
A.它们都是可再生能源
B.石油裂解得到的汽油是纯净物
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
4.下列反应中属于氧化还原反应,且反应物总能量低于生成物总能量的是
A.镁条与稀盐酸反应 B.灼热的碳与C02反应
C.一氧化碳在空气中的燃烧反应 D.碱式碳酸铜的分解反应
2007年秋部分重点中学期中联考高一化学试题 第—1—页 共6页
5.某工厂采用如下步骤从海水中提取镁:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳沉降,过滤,洗涤;③将沉淀物与盐酸反应,结晶,过滤,得到含结晶水的晶体:④将所得晶体在一定条件下加热得到无水氯化镁:⑥电解无水氯化镁,得到金属镁。在以上提取镁的过程中,没有涉及的化学反应类型是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
6.在空气中加热下列固体物质,发生颜色变化且固体质量增加的是
A.苏打 B.胆矾 C.小苏打 D.氧化钠
7.下列关于钠的叙述中正确的是
A.钠是银白色金属,硬度很大
B.钠的熔点很高
C.将钠放在石棉网上加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠
D.将钠投入硫酸铜溶液中,有气体产生,同时有红色的铜析出
8.下列变化中,必须加入还原剂才能实现的是8.下列变化中,必须加入还原剂才能实现的是
A.KMnO4(s)→Mn02 B.HCl→C12
C.As043—→ As033— D.Al(OH)3→Al02—
9.下列反应的离子方程式正确的是
A.锌片插入硝酸银溶液中: Zn +Ag+=Zn2++Ag+
B.碳酸氢钙溶液加到醋酸中: Ca(HC03)2+2CH3C00H=Ca2++2CH3C00—+2C02↑+2H20
C.少量金属钠加到冷水中: Na + 2H20=Na+ + OH— + H2↑
D.盐酸加到氢氧化铁中: Fe(0H)3 + 3H+=Fe3+ + 3H20
10.在无色溶液里能大量共存,但加入盐酸后不能大量共存的离子组是
A.Fe3+、K+、N03—、Ag+ B. Mg2+、 Na+、 C032—、 S042—
C. NH4+、Al3+、Cl—、N03— D.Na+、K+、SO32—、C1—
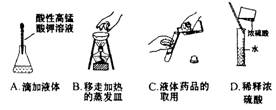 11.下列实验操作或仪器的使用图示中正确的是
11.下列实验操作或仪器的使用图示中正确的是
2007年秋部分重点中学期中联考高一化学试题 第—2—页 共6页
12.下列各组物质的性质比较正确的是
A.热稳定性:Cu(OH)2>Cu0 B.熔点:K>Na>Li
C.还原性:Rb>K>Na D.原子半径:Li>Na>K
13.用一种试剂和必要的实验操作就能鉴别NaHC03、NaCl、KCl、K2S04四种溶液,此试剂与实验操作是
A.盐酸、焰色反应 B.Ba(OH)2溶液、焰色反应
C.盐酸、加热 D.BaCl2溶液、加热
14.常温下,下列3个化学反应均能发生:X2+2W2+=2X—+2W3+,Z2+2X—=2Z—+X2,
2W3++2Y—=2W2++Y2 则在相同条件下,下列反应也能发生的是
A.Y2 +2X—=X2 +2Y— B.Z2 + 2W2+=2Z— + 2W3+
C.2W3+ +2Z—=2W2+ +Z2 D.X2 +2Z—=2X— +Z2
15.下列各组中的两种物质发生反应,反应条件或反应物的用量改变时,对生成物没有影响的是
A.Na0H溶液和C02气体 B.Na202固体和水蒸气
C.钠和氧气 D.Na2C03溶液和盐酸
16.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.Cu(OH)2与盐酸,Cu(OH)2与醋酸
B.BaCl2溶液与Na2S04溶液,Ba(OH)2溶液与(NH4)2S04溶液
C.NaHC03溶液与NaHS04溶液,Na2C03溶液与NaHS04溶液
D.石灰石与稀硝酸,石灰石与稀盐酸 、
17.Na2C03固体中可能含有杂质K2C03、NaHCO3、NaCl中的一种或几种,取10.6g样品,加入足量的稀盐酸产生气体4.8g,下列分析正确的是
A.一定含有NaHC03 B.一定含有K2CO3
C.一定含有NaCl D.一定不含有NaHC03
18.除去下列溶液中的杂质(括号内是杂质)所用试剂不正确的是
A.NaOH溶液[Ba(OH)2]:用Na2SO4溶液
B.KOH溶液[K2C03]:用Ca(OH)2溶液
C.NaCl溶液[Na2SO4]:用Ba(NO3)2溶液
D.HNO3溶液[HCl]:用AgNO3溶液
2007年秋部分重点中学期中联考高一化学试题 第—3—页 共6页
选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第II卷(非选择题,共56分)
本卷包括7小题,共56分。
19.(4分)(1)理、钠、钾各1g,分别与足量的水反应。其中,反应最剧烈的是________,(填
名称)相同条件下,生成氢气质量最大的是__________。(填名称)
(2)一些酸在反应中可以表现出多重性质,如MnO2 +4HCl(浓)=MnCl2+Cl2↑+2H2O,在反应中HCl既表现酸性又表现还原性。分析下列反应中酸的作用:
C12 + H2S03 +H20 =2HCl + H2S04 H2S04:________________
3Cu + 8HN03(稀) = 3Cu(NO3)2 + 2N0↑+ 4H20 HN03:________________
20.(9分)回答下列问题:
(1)在过滤、蒸发、胆矾的溶解等实验操作中都需要用到的仪器是_________
(2)实验中,一位同学不小心将燃着的酒精灯碰翻,正确的处理方法是_______________
____________________________________________________________________________
(3)做完一种物质的焰色反应后,铂丝应如何处理?__________________________________
______________________________________________________________________________
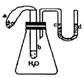 (4)如图所示,试管b中盛有蒸馏水,气球a中盛有干燥的Na202粉末,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口。实验时将气球a中
(4)如图所示,试管b中盛有蒸馏水,气球a中盛有干燥的Na202粉末,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口。实验时将气球a中
的Na202抖落到试管b中。
(1)反应的化学方程式是
_________________________________________
(2)实验现象①:U形管c端液面__________
(填“上升”或“下降”)。说明该反应是_______
反应;(填“放热”或“吸热”)
实验现象②:_________________________________________________
21.(6分)现有以下物质①NaCl晶体 ②干冰 ③无水醋酸 ④石墨 ⑤BaSO4固体 ⑥蔗糖 ⑦汽油 ⑧熔融的KNO3 ⑨氨水 ⑩CH3COONH4晶体 请回答下列问题(填序号):
(1)以上物质能导电的是:_______________________________
(2)以上物质属于强电解质的是:_________________________________
2007年秋部分重点中学期中联考高一化学试题 第—4—页 共6页
(3)以上物质属子非电解质的是:_____________________。
22.(11分)有A、B、C、D、E五种化合物,它们分别由Na+、Ba2+、Cu2+、A13+、Cl—、
S042—和0H—等七种离子中的两种组成。(提示:氢氧化铝不溶于水但既易溶于强酸又易溶于强碱)
(1)白色固体A既不溶于水,也不溶于稀硝酸。
(2)白色固体B不溶于水,但加入焰色反应为黄色的E溶液时,B溶解且生成无色溶液。
(3)C与E具有相同的阴离子,C与稀硫酸反应可以生成A。
(4)D与A阴阳离子均不相同,D溶液与E溶液反应可以得到蓝色沉淀。
根据上述实验事实,回答下列问题:
(1)写出下列物质的化学式:A___________ B__________ C____________
D___________ E___________
(2)写出下列反应的离子方程式:__________________________________________
C溶液与稀硫酸反应:____________________________________________
D溶液与E溶液反应:___________________________________________
Ca(HC03)2溶液与足量的E溶液反应:_____________________________
23.(8分)(1)反应3C12 + 8NH3= 6NH4Cl + N2可用于工业上检查氯气管道是否漏气。该反
应中,电子转移总数为________,参加反应的氨中,被氧化与未被氧化的氨的质量比是________
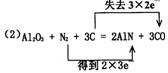
(2)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛地应用于电子工业、 陶瓷工业等领域。在一定条件下,氮化铝可以通过如下反应合成:
A1203 + N2 + 3C = 2AlN + 3C0
用双线桥法标示该反应中电子转移的方向和数目。
(3)已知某温度时发生如下三个化学反应 ① C +C02=2CO:②C + H20=CO+H2 ;
③ C0 +H20=CO2+H2。由此判断,在该温度下,C、C0、H2的还原性由强到弱的顺序是______________
(4)已知5个RO32—与2个X04—恰好完全反应,氧化产物是RO42—,则还原产物中X元素的化合价是_____ 价。
24.(9分)某校课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图I—IV所示。
2007年秋部分重点中学期中联考高一化学试题 第—5—页 共6页
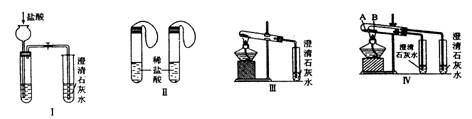
(1)图I、II所示实验中能够达到实验目的的是(填装置序号)__________。
(2)图III、IV所示实验均能鉴别这两种物质,与实验III相比,实验IV的优点是(填选项序
号)______
A.IV比III复杂 B.IV比III安全
C.IV可以做到用同一套装置进行对比实验而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中应装入的固体最好是(填化学
式)____________。
(4)某同学将将质量为m1的NaHC03固体放在试管中加热分解一段时间后,恢复到原条件,测得剩余固体的质量为m2。试管中发生的反应的化学方程式是________________________
生成的Na2C03的质量为_______________________________o
25.(9分)钾是活泼的碱金属,钾和氧除能形成氧化钾、过氧化钾外,还能形成超氧化钾(K02)等化合物。
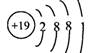
(1) 画出钾的原子结构示意图:
____________________________________________
(2)某过氧化钾样品(杂质不含氧元素)中氧元素的质量分数为28%,则该样品中K2O2的质量分数为__________
(3)超氧化钾能吸收二氧化碳生成K2C03和02,在医院、矿井、潜水、高空飞行中用作供氧剂。
某同学在实验室中将5.3gNa2C03和4.2gNaHC03的混合物与足量盐酸反应所产生的C02气体全部通过足量的K02固体,计算反应所消耗的K02的质量。
2007年秋部分重点中学期中联考高一化学试题 第—6—页 共6页
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | C | B | C | D | C | C | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | C | C | B | B | B | D | A | C |
高一年级化学秋季期中联考试题
19.(4分)(1)钾 锂 (2)还原性 ; 酸性、氧化性(每空1分)
20.(9分)(1)玻璃棒 (1分) (2)用湿抹布或砂子扑灭 (1分) (3)用稀盐酸洗净后
在酒精灯火焰上灼烧至没有颜色(2分) (4)①2Na2O2+2H20=4NaOH +02↑(2分
②下降 放热 气球胀大(或有气泡产生)(各1分)
21.(6分)(1)④⑧⑨(2)①⑤⑧⑩(3)②⑥(各2分,答对一半得1分,多选、少选均无分。
22.(11分)(1)BaS04, Al(0H)3, Ba(OH)2, CuCl2,NaOH (各1分)
(2)Ba2+ +2OH—+2H+ +S042—=BaS04↓ +2H20 Cu2+ +2OH—=Cu(0H)2↓
Ca2++2HC03—+2OH—=CaC03↓+C032—+2H20 (各2分)
 23.(8分)(1)6e—(或6)
1:3(各1分)
23.(8分)(1)6e—(或6)
1:3(各1分)
(3)C>C0>H2 (4)+2(各2分)
24.(9分)(1)II(1分)(2)C(1分)(3)NaHCO3(2分)(4)2NaHC03![]() Na2C03 +C02↑+H20
Na2C03 +C02↑+H20
(2分,反应条件、气体符号错误扣1分,化学式错误、不配平为0分)
62(m1—m2)/106 (3分)
 25.(9分) (1分)
(2)96.25%(2分)
25.(9分) (1分)
(2)96.25%(2分)
(3)设Na2C03、NaHC03与酸反应产生的气体的质量分别为m1,m2
由Na2C03 +2HCl=2NaCl+CO2↑+H20
106 44
5.3g m1 得m1=2.2g (2分)
NaHC03+HCl=NaCl+ CO2↑+H20
84 44
4.2g m2 得m2=2.2g(2分)
设消耗的KO2的质量为X
由4KO2+ 2C02 = 2K2C03+ 302
4×7l 2×44
X 4.4g 得x=14.2g (2分)